Московский государственный университет имени М.В. Ломоносова
Химический факультет
Кафедра аналитической химии
Лаборатория концентрирования
Архипова Виктория Владиславовна
ПРИМЕНЕНИЕ ПЕНОПОЛИУРЕТАНА И НАНОЧАСТИЦ ЗОЛОТА ДЛЯ ОПРЕДЕЛЕНИЯ ТИОЛСОДЕРЖАЩИХ СОЕДИНЕНИЙ МЕТОДАМИ СПЕКТРОФОТОМЕТРИИ И СПЕКТРОСКОПИИ ДИФФУЗНОГО ОТРАЖЕНИЯ
Научный руководитель: к.х.н., н.с. Апяри В.В.
Научный консультант: д.х.н., проф. Дмитриенко С.Г.
СОДЕРЖАНИЕ
|
СОКРАЩЕНИЯ И ОБОЗНАЧЕНИЯ ВВЕДЕНИЕ |
3 4 |
|
ОБЗОР ЛИТЕРАТУРЫ |
5 |
|
1. Применение наночастиц золота в спектрофотометрии и тест-методах анализа |
5 |
|
1.1. Методы получения наночастиц золота и их оптические свойства |
5 |
|
1.2. Применение наночастиц золота для спектрофотометрического и тест-определения ионов металлов и анионов |
8 |
|
1.3. Применение наночастиц золота для спектрофотометрического и тест-определения органических соединений |
13 |
|
2. Формулирование задач исследования |
18 |
|
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ |
22 |
|
1. Объекты исследования, реагенты, аппаратура и техника эксперимента |
22 |
|
2. Методики синтеза наночастиц золота |
24 |
|
3. Агрегация наночастиц золота под воздействием тиолсодержащих соединений |
30 |
|
3.1. Взаимодействие тиолсодержащих соединений с наночастицами золота, стабилизированными цитратом натрия |
30 |
|
3.2. Влияние различных факторов на агрегацию наночастиц золота под воздействием цистеамина |
33 |
|
3.3. Влияние различных факторов на агрегацию наночастиц золота под воздействием цистеина |
39 |
|
4. Сорбция наночастиц золота на пенополиуретане |
46 |
|
5. Применение пенополиуретана и наночастиц золота для определения цистеамина |
51 |
|
6. Спектрофотометрическое определение цистеамина и цистеина в реальных объектах |
56 |
|
6.1. Определение цистеамина |
56 |
|
6.2. Определение цистеина |
60 |
|
ВЫВОДЫ |
62 |
|
ЛИТЕРАТУРА |
64 |
СОКРАЩЕНИЯ И ОБОЗНАЧЕНИЯ
НЧ – наночастицы;
ППР – поверхностный плазмонный резонанс;
СФ – спектрофотометрия;
ВК – визуальная колориметрия;
КПАВ – катионные поверхностно-активные вещества;
ППУ – пенополиуретан;
ЦТМА – бромид цетилтриметиламмония;
СДО – спектроскопия диффузного отражения;
R – степень извлечения;
сmin – предел обнаружения;
ДОС – диапазон определяемых содержаний
Ц – цистеин
ЦА – цистеамин
МЭ – меркаптоэтанол
МПК – меркаптопропионовая кислота
ВВЕДЕНИЕ
Наночастицы золота привлекают в последнее время внимание многих исследователей. Их уникальные оптические свойства обусловлены явлением поверхностного плазмонного резонанса (ППР), которое проявляется в возникновении интенсивной полосы поглощения в видимой области спектра. Высокие молярные коэффициенты поглощения наночастиц золота, а также изменение положения полосы ППР и ее амплитуды в присутствии веществ, вызывающих агрегацию наночастиц, позволяют рассматривать наночастицы золота как своеобразные хромофорные реагенты [1 – 3].
Отличие наночастиц золота от традиционных спектрофотометрических реагентов, для которых возникновение или изменение окраски является следствием изменения электронного состояния реагента или определяемого соединения, состоит в изменении оптических характеристик наночастиц при их агрегации в присутствии определяемого компонента. Возможность функционализации поверхности наночастиц различными по своей природе и химическим свойствам модификаторами и отсутствие каких-либо требований к их хромофорным свойствам позволяет синтезировать чувствительные и селективные реагенты на основе наночастиц для определения широкого круга соединений.
Наиболее целесообразным кажется использование таких реагентов при определении соединений, не имеющих в своем составе хромофорных групп, или получение окрашенных производных которых затруднено. К таким соединениям можно отнести насыщенные тиолсодержащие соединения и некоторые их производные. Многие из этих соединений биологически активны либо ядовиты, некоторые из них применяют в медицине. Поэтому разработка простых, дешевых и экспрессных методов их определения является актуальной задачей.
Цель настоящей работы состояла в изучении возможности применения наночастиц золота и пенополиуретана для определения некоторых тиолсодержащих соединений методами спектрофотометрии и спектроскопии диффузного отражения.
ОБЗОР ЛИТЕРАТУРЫ
1. ПРИМЕНЕНИЕ НАНОЧАСТИЦ ЗОЛОТА В СПЕКТРОФОТОМЕТРИИ И ТЕСТ-МЕТОДАХ АНАЛИЗА
Публикации в области синтеза, исследования свойств и применения наночастиц (НЧ) золота, число которых увеличивается с каждым годом, свидетельствуют о значительном научном и прикладном интересе к этим нанообъектам со стороны исследователей, работающих в различных областях науки. Обширную информацию по способам получения и применению НЧ золота в биохимии и иммунологии можно найти в монографии [4] и обзорах [5 – 8]. Опубликованы обзоры, в которых рассматриваются вопросы использования НЧ золота для адресной доставки лекарств [9 – 11]. Уникальные спектральные свойства наночастиц золота, обусловленные локализованным поверхностным плазмонным резонансом, рассмотрены в обзорах [12 – 14]. Ряд обзоров посвящен контролируемому синтезу НЧ золота в виде сферических [15 – 17] и несферических (нанопалочек, нанопризм, кубиков и других) частиц [18 – 21]. Систематизированы данные по применению НЧ золота в электрохимическом и биоэлектрохимическом анализе [21 – 24], в хроматографических и электрофоретических методах анализа [25 – 30], для создания химических и иммуносенсоров [31 – 37]. В обзоре [38] систематизированы данные по определению тяжелых металлов, белков, нуклеиновых кислот и микроорганизмов с помощью различных наночастиц, включая и НЧ золота. Исследованию свойств НЧ металлов, в том числе и золота аналитическими методами, посвящен обзор [39].
В настоящем обзоре систематизированы сведения о синтезе, оптических свойствах и использовании наночастиц золота в спектрофотометрии и тест-методах анализа, опубликованные преимущественно за последние 5 лет.
1.1. Методы получения наночастиц золота и их оптические свойства
Несмотря на то, что первая статья, посвященная методам синтеза и свойствам коллоидного золота, была опубликована Майклом Фарадаем в 1857 г., это направление не утратило актуальности и в настоящее время. Основные усилия современных исследователей направлены на получение наночастиц золота с различными размерами, формой и узким распределением по размерам, на поиск новых веществ, способствующих их стабилизации, на выявление факторов, связывающих размер, форму и свойства наночастиц с выбранными восстановителями, стабилизаторами и условиями получения. Информация о методах синтеза НЧ золота систематизирована в нескольких обзорах [4, 5, 10 – 16].
Наночастицы золота близкой к сферической формы чаще всего получают химическим восстановлением золотохлористоводородной кислоты. В качестве восстановителей используют цитрат натрия, аскорбиновую кислоту, боргидрид натрия и другие восстановители
Процесс образования НЧ золота протекает через ряд последовательных стадий: возникновение нейтральных атомов; зародышеобразование и формирование начального атомного кластера; рост кластера до определенного размера; стабилизация наночастиц для предотвращения агломерации. Регулирование размеров и дисперсности формируемых наночастиц, а также их устойчивость во времени осуществляется варьированием природы стабилизатора и его количества.
В качестве стабилизаторов используют избыток восстановителя, а также специально вводимые вещества. В последнее время для синтеза монодисперсных НЧ золота стали использовать ионогенные ПАВ, например, додецилсульфат натрия или хлорид лаурилтриметиламмония, ионные жидкости, а также синтетические и природные полимеры – поливинилпирролидон, полиэтиленгликоль, циклодектрины, хитозан и другие.
Помимо стабилизации, для практического использования наночастиц золота часто бывает необходимо осуществить иммобилизацию на их поверхности различных функциональных групп. Большинство описанных в литературе способов иммобилизации лигандов на поверхности наночастиц золота основаны на образовании ковалентной связи Au – S [40 – 43]. Эти подходы предполагают использование серосодержащих лигандов, таких как тиол, дисульфид, тиоэфир, алкантиоляты, глутатион, тиопронин, тиолированный полиэтиленгликоль, тиолированная или модифицированная дисульфидом ДНК и других.
Наиболее распространенным методом получения гидрозолей золота с диаметром частиц 10 – 150 нм является метод Туркевича, основанный на восстановлении золотохлористоводородной кислоты цитратом натрия, а также различные его модификации. Размер наночастиц в пределах 10 – 150 нм можно контролировать, меняя соотношение между цитратом натрия (который в этом случае выполняет функцию не только восстановителя, но и стабилизатора) и золотохлористоводородной кислотой. Этот метод часто применяется по сей день, так как цитрат-ионы на поверхности наночастиц могут быть легко заменены на другой требуемый лиганд, например, тиолированную ДНК [40, 41]. При восстановлении цитратом водный раствор золотохлористоводородной кислоты нагревают до кипения, после чего добавляют цитрат натрия. Образование наночастиц начинается со стадии быстрой нуклеации, после чего происходит их диффузионный рост [15]. Размер наночастиц, получаемых цитратным методом, зависит от соотношения цитрат:золотохлористоводородная кислота: средний диаметр частиц уменьшается при увеличении концентрации цитрата в реакционной смеси [41 – 43].
В основе уникальных оптических свойств наночастиц золота лежит явление поверхностного плазмонного резонанса [4, 5, 12 – 14, 16, 40]. Оно возникает как следствие коллективного поведения делокализованных электронов проводимости на поверхности частицы, которое проявляется, в частности, во взаимодействии с внешними электромагнитными полями. Это приводит к появлению в спектрах поглощения максимумов, отвечающих наступлению условий резонанса при совпадении частоты электромагнитного излучения с собственной частотой колебаний поверхностных плазмонов. Такие колебания носят названия плазмонных, а резонанс – поверхностного плазмонного резонанса.
Поскольку для наночастиц характерна высокая доля поверхностных атомов, положение и форма полосы ППР сильно зависит от локальной диэлектрической проницаемости среды вблизи поверхности. Поэтому любое изменение в окружении частиц (поверхностное модифицирование, агрегация, изменение показателя преломления среды и др.) приводят к изменению их оптических свойств [40, 41, 47, 48]. Так, например, если частицы формируют агрегаты, то в результате диполь-дипольных взаимодействий индуцированных излучением дипольных моментов частиц соответствующий плазмонный пик смещается в сторону больших длин волн и уширяется.
Для сферических наночастиц золота в водном растворе полоса ППР лежит в видимой области спектра. Положение ее максимума зависит от среднего размера наночастиц и смещается в область больших длин волн с ростом диаметра частиц.
Сильное влияние на полосу ППР наночастиц золота оказывает их агрегация. На этом эффекте основано большинство известных на сегодняшний день оптических сенсоров на основе наночастиц золота. Агрегация наночастиц золота приводит к изменению цвета с рубиново-красного на фиолетовый или синий. Такой переход является контрастным и может с успехом использоваться для визуального детектирования. Именно агрегативные процессы функионализированных определенными группами наночастиц используют для детектирования нуклеиновых кислот, белков, аминокислот и других биологически-значимых органических соединений [4, 5, 36].
1.2. Применение наночастиц золота для спектрофотометрического и тест-определения ионов металлов и анионов
Стратегия применения наночастиц золота в спектрофотометрическом анализе в большинстве случаев сводится к следующему: к раствору определяемого компонента добавляют определенное количество предварительно синтезированных НЧ золота и регистрируют изменения оптических характеристик анализируемых растворов спектрофотометрически или визуально.
Общие сведения об определении ионов металлов и анионов с использованием наночастиц золота систематизированы в табл. 1.
Для определения ионов металлов используют подход, основанный на выборе подходящего модификатора, способного образовывать прочные связи с ионами металлов. Вследствие взаимодействия иона металла с молекулами модификатора, находящимися на поверхности наночастиц золота, происходит либо их «сшивание», что приводит к сближению наночастиц, то есть их агрегации, либо отрыв молекулы модификатора или ее частей, что может привести как к агрегации наночастиц, так и к их дополнительной стабилизации.
Таблица 1. Примеры спектрофотометрического (СФ) и визуально-колориметрического (ВК) определения ионов металлов и анионов в различных объектах с помощью наночастиц золота
|
Ион |
Объект анализа |
Метод синтеза НЧ, тип функционализации |
сmin |
Метод |
Лите-ратура |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Ионы металлов |
|||||
|
Hg (II) |
Модельная система |
Цитратный, функционализация пептидом |
26 нМ |
ВК |
49
|
|
Грунтовые воды |
Цитратный, функционализация олигонуклеотидом |
10 нМ |
СФ |
50 |
|
|
Природные воды |
Цитратный, функционализация ДНК |
10 нМ |
СФ |
51, 52 |
|
|
Модельная система |
Боргидридный, функционализация дитиадиазо-2-[3-(2-аминоэтилсульфанил)-пропилсульфанил]-этиламином |
35 нM
|
СФ |
52 |
|
|
Pb (II) |
Модельная система |
Цитратный, функционализация пептидом |
242 нМ |
ВК |
49 |
|
Модельная система, по составу имитирующая физиологические жидкости |
Цитратный, функционализация ДНК |
1 мкМ |
ВК |
52 |
|
|
Морская вода, моча, кровь.
|
Цитратный, функционализация бычьим сывороточным альбумином |
50 пM
|
ВК |
54 |
|
|
Cd (II) |
Озерная вода |
Цитратный, функционализация 6-меркаптоникотиновой кислотой и L-цистеином |
1,0 •10-7 М |
СФ |
55 |
|
Co (II) |
Модельная система |
Цитратный, функционализация пептидом |
190 нМ |
ВК |
49 |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Cu (II) |
Модельная система |
Цитратный, функционализация ДНК |
5 мкМ |
ВК |
56 |
|
Pd (IV)
|
Модельная система |
Цитратный, функционализация пептидом |
31 нМ |
ВК |
49 |
|
Pt (IV)
|
Модельная система |
Цитратный, функционализация пептидом |
23 нМ |
ВК |
49 |
|
K (I) |
Модельная система |
Цитратный |
1 мМ |
СФ, ВК |
57 |
|
Ca (II) |
Плазма крови |
Цитратный, функционализация кальсеквестрином |
1 мМ |
СФ, ВК |
58 |
|
As (III) |
Грунтовые воды |
Цитратный, функционализация глутатионом, дитиотреи-толом и цистеином |
0,13 нМ |
СФ, ВК |
59, 60 |
|
Cr (III) |
Модельная система |
Цитратный, функционализация 5,5’-дитиобис(2-нитро-бензойной кислотой) |
1,8 мкМ |
СФ, ВК |
61 |
|
Речная вода |
Боргидридный, функционализация триполифосфатом P3O105- |
1,0 •10-7 M
|
ВК |
62 |
|
|
Al (III) |
Поверхность клетки |
Цитратный, функционализация пентапептидом |
0,2 мкМ |
СФ, ВК |
63 |
|
Ag (I) |
Модельная система |
Цитратный, функционализация ДНК |
0,59 нМ |
СФ, ВК |
64 |
|
Анионы |
|||||
|
H2PO4- |
Модельная система на основе дихлорметана |
Боргидридный, функционализация фенилмочевиной |
10 мкМ |
СФ |
65 |
|
Cr2O72- |
Природные воды |
Цитратный, функционализация дитиотреитолом |
20 нМ |
СФ |
66 |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
F- |
Модельная система |
Функционализация тиоглюкозой |
- |
ВК |
67 |
|
NO2- |
Природные воды |
Цитратный, функциона-лизация остатками анилина и нафтиламина |
22 мкМ |
ВК |
68 |
|
CN- |
Модельная система |
Цитратный, функционализация аденозинтрифосфатом |
14 мкМ |
СФ, ВК |
69 |
|
Оксо-анионы (HPO42-) |
Модельная система |
Боргидридный, функционализация изотиоуронием |
100 мкМ |
СФ, ВК |
70 |
|
SO42- |
Модельная система |
Боргидридный, функционализация цистеамином |
50 мкг/л |
ВК |
71 |
Процесс агрегации сопровождается сильным изменением оптических характеристик системы. Подобный эффект можно условно изобразить в виде следующей схемы [49]:

В работе [49] такой подход предложен для определения ртути, свинца, кобальта, палладия и платины. Использовали НЧ, функционализированные пептидом. Полученные после агрегации системы отличаются по спектральным характеристикам (положение и форма полосы поглощения) и цвету, что было использовано для тест-обнаружения ионов металлов. Интересно отметить, что наблюдаемое изменение окраски изначально окрашенных в рубиновый цвет наночастиц золота зависит от определяемого иона металла. Так, в присутствии ртути она становится сине-фиолетовой, свинца – сине-зеленой, кобальта – коричневой, палладия – вишневой, платины – грязно-фиолетовой. Пределы обнаружения металлов лежат на уровне 20 – 200 нМ.
В случае использования НЧ, модифицированных ДНК, взаимодействие тиминовых оснований с ионами ртути оказывается настолько сильным, что оно приводит к удалению ДНК с поверхности НЧ и вызывает агрегацию последних [50]. При использовании в качестве аналитического сигнала соотношения оптических плотностей раствора при 650 и 520 нм метод позволяет проводить определение ртути в диапазоне концентраций 10-8 – 10-6 М.
Обратный эффект, а именно изменение цвета раствора за счет перехода от агрегированных НЧ к индивидуальным, положен в основу методики определения свинца [72]. Он основан на способности свинца в присутствии определенных ферментов вызывать разрыв первичной структуры ДНК в местах мутаций, приводящих к нарушению ее двойной спирали. Отрыв участков молекулы ДНК приводит к возникновению первичной последовательности нуклеотидов, не имеющей комплементарной, способной вызывать дополнительную стабилизацию наночастиц золота. Поэтому, в отличие от описанного выше подхода, при добавлении ионов свинца к агрегированным НЧ наблюдается их стабилизация. С помощью описанного способа можно проводить определение свинца с пределом обнаружения 3 нМ. Более полную информацию о методах определения ионов ртути, свинца и меди можно найти в обзоре [73].
Принципы определения анионов также включают модифицирование наночастиц подходящими агентами, способными к взаимодействию с анионами. Такими агентами являются соединения – доноры протонов. Например, в работе [65] предложено использовать НЧ, функционализированные фенилмочевиной, в дихлорметане для определения дигидрофосфат-ионов. В рассматриваемом случае NH-группы фенилмочевины выполняют роль доноров протонов, в то время как анион является их акцептором. Прочность связывания аниона, согласно данной работе, зависит от его основности и способности образовывать водородные связи. Взаимодействие с анионом препятствует образованию межчастичных водородных связей, что вызывает пептизацию НЧ и увеличение полосы ППР при 510 нм. Подход перспективен для определения анионов в неполярных средах, но вследствие гидрофобности функционализированных НЧ неприменим для водных растворов. Для этого случая авторы предложили НЧ, функционализированные цистеином и фенилмочевиной, однако метод показал низкую чувствительность и узкий диапазон линейности (4 – 8 мМ), а также плохую селективность.
Метод определения дихромат-ионов [64] основан на их окислительной способности. Дихромат-ионы окисляют меркаптогруппы в молекуле дитиотреитола, что приводит к образованию дисульфидной связи между наночастицами. Этот способ принципиально отличается от описанного выше тем, что в данном случае анион не участвует непосредственно в формировании связей между отдельными НЧ, а лишь создает условия для их образования, изменяя молекулы модификатора. Контроль может быть осуществлен как визуально, так и с использованием спектрофотометрии, в последнем случае в роли аналитического сигнала используют отношение оптических плотностей А650/А520. Предел обнаружения дихромата равен 20 нМ. Методика пригодна для анализа природных вод.
1.3. Применение наночастиц золота для спектрофотометрического и тест-определения органических соединений
Общие сведения об определении органических соединений спектрофотометрическим методом при помощи НЧ золота систематизированы в табл. 2. Все они могут быть разделены на несколько типов.
В методах первого типа определение органических соединений проводят при помощи наночастиц золота, модифицированных цитратом: определяемое органическое соединение сорбируется на НЧ, что приводит к нейтрализации отрицательного заряда ее поверхности, либо замещает цитрат-ионы на их поверхности, что также уменьшает заряд наночастицы и вызывает ее агрегацию. Так, например, в работе [74] описан способ полуколичественного определения катионных ПАВ. Авторы предполагают, что при небольших концентрациях ПАВ (меньше ККМ) они адсорбируются на отрицательно заряженных наночастицах, вызывают их гидрофобизацию и агрегацию, что приводит к изменению цвета с
Таблица 2. Примеры спектрофотометрического (СФ) и визуально-колориметрического (ВК) определения органических соединений в различных объектах с помощью наночастиц золота
|
Соединение |
Объект анализа |
Метод синтеза НЧ, тип функционализации |
Метрологические характеристики |
Метод |
Лите-ратура |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Катионные ПАВ |
Кондиционер для волос |
Цитратный |
Определение на уровне ККМ |
ВК |
74 |
|
Цистеин |
Модельная система |
Цитратный |
ДОС:10−6 -10−4 М |
СФ |
75 |
|
Моча |
Цитратный, функционализация фторсодержащим ПАВ |
0,8 мкМ |
СФ, ВК |
76 |
|
|
Модельная система |
Цитратный, в присутствии Cu(II) |
10 нM
|
ВК |
77 |
|
|
Тринитро-толуол |
Природные воды |
Цитратный, функционализация цистеамином |
0,5 нМ |
СФ, ВК |
78 |
|
Кортизол |
Сыворотка крови |
Цитратный метод, функционализация антигеном |
сmin : 30 нг/мл |
ВК |
79 |
|
Меламин |
Молоко, детское питание |
Цитратный |
сmin : 0,15 мкг/мл; сmin : 1,0 мкг/мл |
СФ; ВК |
80 |
|
Молоко |
Цитратный, функционализация политимином |
0,02 мкМ |
СФ, ВК |
81 |
|
|
Модельная смесь |
Боргидридный, функционализация рибофлавином (витамин В2) |
0,25-0,5 мкМ |
СФ |
82 |
|
|
Молоко |
Цитратный, функционализация цистеамином |
1 мг/л |
СФ |
83 |
|
|
Олиго-нуклеотиды |
Модельная система |
Цитратный, функционализация аптамером |
сmin : 0,5 нМ ДОС: 1 – 10 нМ |
ВК |
84 |
|
Тиолсодер-жащие ами-нокислоты |
Модельная система |
Цитратный |
ДОС: 3 – 15 мкМ |
ВК |
85 |
|
Тиолы |
Модельная система |
Цитратный, функционализация дисульфидом |
Определение на уровне 1 мкМ |
ВК |
86 |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Теофиллин |
Модельная система |
Цитратный, функционализация ДНК |
ДОС: 200 – 500 мкМ |
СФ |
87 |
|
Кокаин |
Модельная система |
Цитратный |
2 мкМ |
ВК |
88 |
|
Дофамин |
Модельная система |
Цитратный |
0,03 мкМ |
СФ, ВК |
89 |
|
Аденозинтрифосфат |
Модельная система |
Цитратный |
0,6 мкМ |
СФ, ВК |
90 |
|
Глюкоза |
Микродиализат мозга мыши |
Цитратный |
1 мМ |
СФ, ВК |
91 |
|
Сыворотка крови
|
Цитратный
|
10 нM
|
СФ |
92 |
|
|
Аскорбино-вая кислота |
Фруктовый сок |
Цитратный |
3 нM
|
ВК |
93 |
|
Стрепто-мицин |
Парное молоко
|
Функционализация меркаптоуксусной кислотой
|
50 мкг/л
|
СФ |
94 |
|
Фосфор-органические пестициды и карбаматы
|
Речная вода |
Цитратный, функционализация родамином В
|
0,1, 0,1, 0,3 и 1 мкг/л для карбарила, диазинона, малатиона и фората соответственно
|
СФ |
95 |
рубинового на сине-фиолетовый. При концентрациях больше ККМ наблюдается восстановление рубиновой окраски растворов, что авторы связывают с образованием мицелл, где наночастицы находятся на их гидрофильной поверхности (рис. 1).
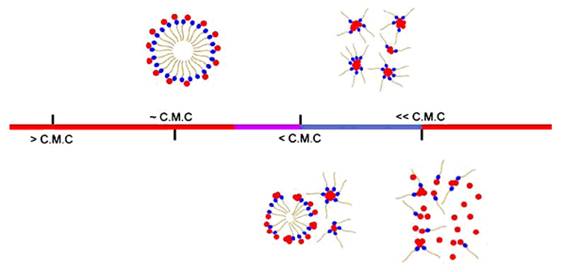
Рис. 1. Вероятный механизм изменения цвета наночастиц золота в присутствии катионных ПАВ [74].
Нам, однако, кажется маловероятным образование подобных структур в силу относительно большой массы и размеров наночастиц золота. Более адекватный, на наш взгляд, механизм восстановления оптических характеристик растворов включает инкапсуляцию гидрофобизированных НЧ золота в неполярные полости мицелл ПАВ. В этом случае каждая частица оказывается окружена двойным слоем ПАВ, внутренняя часть которого образована углеводородными радикалами. Как видим, подход основан на использовании двух типов взаимодействий – электростатических и гидрофобных, – что делает его универсальным для определения различных КПАВ и оценки их суммарного содержания. Необходимо отметить, что неионогенные и анионные ПАВ не вызывают агрегации наночастиц золота. Недостатком описанного способа является немонотонная зависимость оптической плотности от концентрации КПАВ, а также сильное мешающее влияние со стороны других положительно заряженных соединений или ионов.
Еще один пример визуально-колориметрического определения, основанный на использовании модифицированных цитрат-ионами НЧ золота, применительно к тиол-содержащим аминокислотам можно найти в работе [85]. Суть предлагаемого подхода заключается в вытеснении цитрат-ионов молекулами тиол-содержащих аминокислот за счет более сильного взаимодействия атома серы меркаптогруппы с атомом золота на поверхности наночастиц, что приводит к агрегации последних. Путем замещения меркаптогруппы в молекуле гомоцистеина на гидроксил, авторы доказали, что за образование прочной связи с поверхностью НЧ золота отвечает именно меркаптогруппа (в случае введения в раствор наночастиц гидроксил-замещенного производного изменения оптических свойств системы не наблюдалось). Принципиальным отличием данного примера от описанного выше является доказанный авторами факт замещения цитрат-ионов на поверхности золота. По сути, в этом случае между определяемым соединением и НЧ золота реализуются специфические взаимодействия, приводящие к образованию ковалентной связи с поверхностью наночастицы, что с одной стороны делает такой подход более селективным, а с другой – накладывает определенные ограничения на круг определяемых таким образом соединений.
Подобный прием был использован в работе [80] для тест-определения меламина. Авторы полагают, что за счет специфических взаимодействий аминогрупп меламина с поверхностными атомами золота происходит вытеснение с поверхности НЧ цитрат-ионов, что приводит к уменьшению ее агрегативной устойчивости. Предлагаемый метод позволяет проводить определение меламина в молоке и детском питании с пределом обнаружения 1,0 мкг/мл в случае визуально-колориметрического детектирования и 0,15 мкг/мл в случае спектрофотометрического.
Наконец, также как и при определении ионов металлов и анионов, широко распространены приемы модифицирования (функционализации) поверхности наночастиц различными соединениями и группами, позволяющими селективно детектировать целевые органические молекулы. При этом вещество, отвечающее за селективное «распознавание» молекулы аналита может быть добавлено и непосредственно в раствор. В зависимости типа соединения-модификатора и определяемого соединения аналитический сигнал может формироваться как в результате агрегации наночастиц, так и в результате протекания конкурирующего процесса с аналитом, препятствующего агрегации. Пример реализации последнего случая может быть найден в работе [90].
2. ФОРМУЛИРОВАНИЕ ЗАДАЧ ИССЛЕДОВАНИЯ
Проведенный анализ литературных данных указывает на то, что в последние пять лет заметно возросло число публикаций, посвященных использованию наночастиц золота в спектрофотометрии. Применение наночастиц золота в спектрофотометрии основано на эффекте поверхностного плазмонного резонанса, который проявляется в возникновении интенсивной полосы поглощения в видимой области спектра. Согласно данным зарубежных исследователей, этот эффект используют для разработки методик определения ионов металлов, анионов и органических соединений, способных вызывать агрегацию наночастиц, что проявляется в уменьшении интенсивности полосы поверхностного плазмонного резонанса при 510 – 530 нм и возникновении полосы поглощения агрегатов в области 650 –800 нм. Различают, по крайней мере, два основных механизма агрегации наночастиц золота [96]. Согласно первому (Interparticle Crosslinking Aggregation), агрегация наночастиц происходит за счет связывания определяемого соединения с лигандами, используемыми для их функционализации. Второй механизм основан на направленном замещении стабилизирующих лигандов на поверхности наночастиц определяемыми компонентами (Noncrosslinking Aggregation).
Основными факторами, свидетельствующими в пользу применения наночастиц золота в спектрофотомерии, являются относительная простота получения, высокие молярные коэффициенты поглощения, а также практически неограниченная возможность регулирования спектральных характеристик наночастиц путем изменения их размеров, формы и химического окружения. Спектрофотометрические методики, основанные на применении наночастиц золота, отличаются простотой, экспрессностью и дешевизной. Благодаря контрастному изменению цвета растворов их легко можно реализовать и в тест-варианте.
Несмотря на достигнутые успехи в области использования НЧ золота в спектрофотометрии, в практике их применения для анализа реальных объектов есть ряд нерешенных вопросов. В реальных объектах, таких, например, как биологические жидкости (кровь, моча, сыворотка), пищевые продукты или объекты окружающей среды, присутствуют различные соли или другие вещества, способные вызывать агрегацию наночастиц и в отсутствие определяемых компонентов. Между тем, сведения об использовании маскирующих агентов для устранения такого влияния единичны. Кроме того, чувствительность разработанных спектрофотометрических методик не всегда соответствует реальному (более низкому) содержанию определяемых компонентов. Проблему можно было бы решить в рамках сорбционно-спектроскопических методов анализа. В настоящей работе для этой цели предложено использовать пенополиуретан. Немаловажное значение в плане повышения селективности разрабатываемых методик имеет также и дальнейшее изучение механизмов агрегации, и выбор в этой связи веществ-модификаторов наночастиц.
Расширение возможностей применения наночастиц золота в спектрофотометрии в значительной степени зависит и от поиска новых аналитических систем. На наш взгляд, наночастицы золота в качестве спектрофотометрического реагента наиболее целесообразно использовать для определения органических соединений, не имеющих в своем составе хромофорных групп, а также для тех соединений, получение окрашенных производных которых затруднено. В рамках настоящей работы в качестве таких соединений были выбраны некоторые тиолсодержащие соединения, такие как цистеамин, цистеин, меркаптоэтанол и меркаптопропионовая кислота.
Выбор этих соединений был обусловлен, прежде всего, наличием в их структуре тиольных групп, способных взаимодействовать с НЧ золота, а также различных по свойствам функциональных групп: - NH2, -OH, -COOH. Кроме того, при выборе объектов исследования учитывали и практический интерес: большинство из перечисленных выше соединений относятся к биологически активным или лекарственным веществам и разработка экспрессных и простых методик их определения представляет интерес.
Так, например, цистеамин (2-меркаптоэтиламин, 2-аминоэтантиол, 2-амино-этилмеркаптан, тиоэтаноламин, меркамин) обладает антиоксидантной активностью [97], его используют в составе различных радиопротекторов, защищающих организм от ионизирующего излучения. Кроме того, цистеамин используют в качестве лекарственного средства для лечения цистиноза и серповидно-клеточной анемии [98, 99]. Цистеамин является важным посредником в процессе биосинтеза таурина и образуется в тканях млекопитающих при ферментативном расщеплении пантетеина и в процессе декарбоксилирования цистеина. Однако, несмотря на физиологическую важность и клиническое применение, определению цистеамина в биологических жидкостях посвящено сравнительно незначительное число работ, что, по-видимому, связано с трудностями, возникающими как при подборе дериватизирующих агентов, так и при проведении самой процедуры дериватизации. В большинстве описанных работ анализируемые образцы восстанавливают боргидридом натрия, а затем проводят дериватизацию. В качестве дериватизирующего агента для определения цистеамина в виде N,S-диизобутоксикарбонила методом газовой хроматографии с пламенно-фотометрическим детектором предложено использовать изобутилхлорформиат [100]. Цистеамин определяют также методом ВЭЖХ с флуоресцентным [101] или УФ-детектором [102] после реакции дериватизации с N-(1-пиренил) малеимидом и 2-хлор-1-метилхинолин тетрафтороборатом соответственно. В ранних работах для определения цистеамина использовали метод ВЭЖХ с амперометрическим детектором [103, 104]. Несколько работ посвящено определению этого соединения различными электрохимическими методами [105, 106].
Цистеин (α-амино-β-тиопропионовая кислота; 2-амино-3-меркаптопропановая кислота) является одной из важнейших алифатических серосодержащих аминокислот. Он играет важную роль в ряде важных клеточных функций, таких как детоксикация и метаболизм [107]. Цистеин является одним из самых мощных антиоксидантов, он выполняет роль строительного материала для всех протеинов, терапевтические дозы цистеина в значительной степени защищают организм от воздействия рентгеновских лучей и радиации. Недостаток цистеина в организме является причиной появления таких синдромов, как обесцвечивание волос, отеки, повреждения печени, поражения кожи, вялости мышечной и жировой тканей [108]. Поэтому определение цистеина вызывает огромный интерес в последние годы [109]. Определение цистеина, как и цистеамина, в большинстве случаев проводят в виде его флуоресцирующих или окрашенных производных методами хемилюминесценции [110, 111], флуоресценции [112], или ВЭЖХ [113]. Кроме того, в последние годы появились работы, в которых для спектрофотометрического [75 – 77, 85, 113 – 116] или электрохимического [117] определения цистеина предложено использовать наночастицы золота.
Цель настоящей работы состояла в изучении возможности применения наночастиц золота и пенополиуретана для определения цистеамина, цистеина и некоторых других тиолсодержащих соединений методами спектрофотометрии и спектроскопии диффузного отражения.
Достижение поставленной цели предусматривало решение следующих задач:
– получение наночастиц золота, стабилизированных цитрат-ионами, ЦТМА и меркаптоэтанолом;
– изучение особенностей агрегации наночастиц золота в присутствии тиолсодержащих соединений в зависимости от их природы, типа наночастиц и их концентрации, рН раствора и ряда других факторов;
– изучение особенностей агрегации наночастиц золота в присутствии тиолсодержащих соединений и ЭДТА;
– изучение сорбции наночастиц золота и их агрегатов на пенополиуретане; оптимизацию условий получения ППУ, модифицированного наночастицами золота, для их дальнейшего использования в спектроскопии диффузного отражения;
– разработку методик определения цистеамина и цистеина в различных объектах с применением спектрофотометрии и спектроскопии диффузного отражения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. ОБЪЕКТЫ ИССЛЕДОВАНИЯ, РЕАГЕНТЫ, АППАРАТУРА И МЕТОДИКА ЭКСПЕРИМЕНТА
Объекты исследования. В качестве объектов исследования были выбраны цистеамина гидрохлорид (ч.д.а., «Aldrich»), цистеин (ч.д.а., «Aldrich»), меркаптоэтанол (ч.д.а., «Aldrich») и меркаптопропионовая кислота (ч.д.а., «Aldrich»). В табл. 3 приведены их структурные формулы и перечислены объекты, в которых их нужно определять.
Таблица 3. Объекты исследования
|
Название |
Формула |
Объекты |
|
Цистеамин (ЦА) |
HS – CH2 – CH2 –NH2 |
Лекарственные препараты Радиопротекторы Средства для волос Биологические жидкости |
|
Цистеин (Ц) |
HS – CH2 – CH (NH2)– COOH |
Лекарственные препараты Биодобавки Пищевые продукты |
|
Меркаптоэтанол (МЭ) |
HS – CH2 – CH2 – OH |
Воздух промышленных предприятий ПДК в воздухе 1 мг/м3 |
|
Меркаптопропио-новая кислота (МПК) |
HS – CH2 – CH2 – COOH |
Воздух промышленных предприятий ПДК в воздухе - 0,1 мг/м3 |
Реагенты. В ходе экспериментов также были использованы: золотохлористоводородная кислота (х.ч.), цитрат натрия (х.ч.), боргидрид натрия (х.ч.), цетилтриметиламмония бромид (ЦТМА) (х.ч.), динатриевая соль этилендиаминтетрауксусной кислоты (ч.д.а), NaOH (ч.д.а), HCl (х.ч.). Реагенты использовали без дополнительной очистки.
Исходные растворы тиолсодержащих соединений (100-1000 мкг/мл) готовили растворением их точных навесок (либо аликвот) в деионизованной воде. Рабочие растворы соединений готовили разбавлением исходных непосредственно перед использованием. Рабочий 0,25 М раствор ЭДТА готовили растворением точной навески соединения в 0,25 М растворе гидроксида натрия.
В качестве сорбента применяли пенополиуретан (ППУ) торговой марки 5-30 на основе простых эфиров. Таблетки ППУ диаметром 16 мм и массой (20 ± 2) мг выбивали металлическим пробойником из промышленного листа полимера. Для очистки от примесей таблетки ППУ помещали в ацетон и встряхивали в течение 10 минут, процедуру повторяли дважды, после чего их высушивали под струей воздуха. Таблетки хранили в защищенном от света месте.
Аппаратура. Измерение оптической плотности растворов проводили на спектрофотометре СФ-103 фирмы «Аквилон» в диапазоне длин волн 400 – 800 нм. Диффузное отражение и спектры диффузного отражения в видимой области регистрировали на мини-спектрофотометре Eye-One Pro швейцарской фирмы X-Rite, предложенном в нашей научной группе в качестве альтернативы спектрометру диффузного отражения [118]. Значения рН контролировали на иономере «Эксперт 001». Хроматограммы образцов регистрировали на жидкостном хроматографе «Цвет Яуза» (НПО Химавтоматика) с амперометрическим детектором (Е = 1 В). Использовали хроматографическую колонку «Luna С18». В качестве подвижной фазы использовали смесь, состоящую на 35% ацетонитрила и 65% воды. Объем пробы составлял 20 мкл, ввод пробы осуществляли с помощью петли дозатора. Скорость потока составляла 0,4 мл/мин. Электронно-микроскопические исследования проводили на просвечивающем электронном микроскопе (LEO912 AB OMEGA, центр коллективного пользования МГУ имени М. В. Ломоносова). Также использовали механический шейкер, магнитную мешалку и колбонагреватель.
Техника эксперимента. Для изучения агрегации наночастиц под воздействием тиолсодержащих соединений в пробирки для встряхивания вносили последовательно тиолсодержащее соединение, деионизованную воду, ЭДТА и раствор НЧ золота. Суммарный объем всех компонентов составлял 10 мл. Спектры поглощения полученных водных растворов измеряли по истечении 2 мин.
Для изучения сорбции тиолсодержащих соединений на ППУ в пробирки для встряхивания вносили последовательно тиолсодержащее соединение, деионизованную воду, ЭДТА и раствор НЧ золота. Через 2 мин в полученные растворы вносили по одной таблетке ППУ, тщательно прожимали таблетку стеклянной палочкой для удаления воздуха и встряхивали пробирки на механическом шейкере до достижения сорбционного равновесия – 30 мин. Затем таблетки ППУ извлекали, высушивали между листов фильтровальной бумаги и измеряли диффузное отражение.
Контроль за распределением наночастиц золота в системе водный раствор – ППУ осуществляли спектрофотометрически. О содержании наночастиц золота в фазе ППУ судили, измеряя значения функции Кубелки-Мунка F при длине волны, соответствующей максимуму поглощения (lmax):
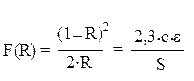
где R — диффузное отражение; e — молярный коэффициент поглощения сорбата, М-1 см-1; c — его концентрация, М; S — коэффициент рассеивания, см-1.
2. МЕТОДИКИ СИНТЕЗА НАНОЧАСТИЦ ЗОЛОТА
С целью изучения влияния природы модификатора наночастиц и их заряда на процессы агрегации в присутствии тиолсодержащих соединений были синтезированы наночастицы трех типов: отрицательно заряженные наночастицы, стабилизированные цитрат-ионами, положительно заряженные наночастицы, стабилизированные ЦТМА, и незаряженные наночастицы, стабилизированные меркаптоэтанолом.
Ниже приведены методики синтеза наночастиц золота указанных типов.
Методика синтеза наночастиц золота, стабилизированных цитратом натрия. Синтез наночастиц золота, стабилизированных цитратом натрия, осуществляли по методу Френса [119]. В качестве восстановителя и стабилизатора использовали цитрат натрия. К преимуществам наночастиц, полученных таким способом, можно отнести узкое распределение по размерам, интенсивную полосу поглощения в водных растворах при 525 нм, а также способность относительно легко агрегировать в присутствие некоторых соединений, что приводит к появлению в спектре поглощения полосы агрегатов наночастиц при 650 – 750 нм.
Для осуществления синтеза 1 мл 1%-го раствора HAuCl4 вносили в круглодонную колбу емкостью 250 мл, добавляли 100 мл деионизованной воды и доводили до кипения. Затем переносили колбу на магнитную мешалку и при перемешивании добавляли к горячему раствору 1,4 мл 1%-го раствора цитрата натрия. После того как раствор приобрел темно-синюю окраску, магнитный якорек извлекали, а раствор нагревали и кипятили в течение 5 мин до появления устойчивой рубиновой окраски. Смесь охлаждали при перемешивании. Полученный раствор выдерживали в темном месте в течение 1 суток для полной стабилизации наночастиц и завершения процессов перекристаллизации.
Концентрация НЧ золота, синтезированных таким образом, оказалась равной 68 мкг/мл (0,35 мМ по золоту).
Методика синтеза наночастиц золота, стабилизированных цетилтриметиламмоний бромидом. Синтез наночастиц золота, стабилизированных ЦТМА осуществляли по боргидридной методике, подобно описанным в литературе [120, 121]. Согласно литературным данным [122] такие наночастицы заряжены положительно. В данной методике в качестве восстановителя использовали боргидрид натрия, в качестве стабилизатора – ЦТМА.
К 10 мл 0,012 М раствора хлорида ЦТМА по каплям при интенсивном перемешивании добавляли 10 мл 0,05 % раствора HAuCl4, полученный раствор перемешивали 15 мин. Затем по каплям при перемешивании добавляли 20 мл 0,05 % раствора NaBH4. После перемешивания в течение 30 мин раствор выдерживали 1 сутки для полной стабилизации НЧ и завершения процессов перекристаллизации.
Концентрация НЧ золота, синтезированных таким образом, оказалась равной 73 мкг/мл (0,37 мМ по золоту).
Методика синтеза наночастиц золота, стабилизированных меркаптоэтанолом. Синтез наночастиц золота, стабилизированных меркаптоэтанолом осуществляли по боргидридной методике, по аналогии с методикой синтеза наночастиц, стабилизированных ЦТМА. В данной методике в качестве восстановителя использовали боргидрид натрия, в качестве стабилизатора – МЭ.
К 10 мл 0,01 М раствора меркаптоэтанола по каплям при интенсивном перемешивании добавляли 10 мл 0,05 % раствора HAuCl4,, полученный раствор перемешивали 15 мин. Затем к раствору по каплям, при постоянном перемешивании добавляли 20 мл 0,05 % раствора NaBH4, и перемешивали раствор в течение 30 мин. Концентрация НЧ золота в растворе равна 73 мкг/мл (0,37 мМ).
Поскольку наночастицы золота, стабилизированные меркаптоэтанолом, незаряжены, их водные растворы неустойчивы и подвергаются агрегации в течение суток. Поэтому во всех экспериментах использовали только свежеприготовленные золи таких наночастиц.
Характеристика растворов наночастиц золота. Как уже упоминалось выше, важной особенностью НЧ золота является наличие в спектрах поглощения полосы поверхностного плазмонного резонанса при 510 – 530 нм. Спектры поглощения водных растворов наночастиц золота, синтезированных по описанным выше методикам, приведены на рис. 2, из сравнения которых видно, что максимум полосы ППР наблюдается при 525, 515 и 530 нм для наночастиц, стабилизированных цитратом, ЦТМА и меркаптоэтанолом соответственно.
Присутствие наночастиц золота в растворах было подтверждено электронно-микроскопическим исследованием. Как видно из микрофотографии (рис. 3) и гистограммы распределения наночастиц по размерам (рис. 4), в растворе наночастиц, синтезированных по цитратной методике, преобладают частицы с размером 18 – 26 нм, средний диаметр наночастиц равен 23 нм. Электронограмма, приведенная на рис. 3 (б), подтвердила, что это наночастицы золота.
В растворе наночастиц, стабилизированных ЦТМА, преобладают частицы с размером 1 – 4 нм, средний диаметр наночастиц равен 2,6 нм (рис. 5, 6). Полученные результаты согласуются с литературными данными, в соответствии с которыми положение максимума ППР зависит от среднего размера наночастиц и смещается в область больших длин волн с ростом диаметра частиц.
 а
б
а
б
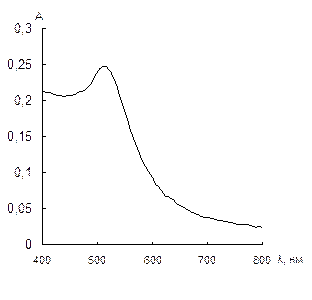
в
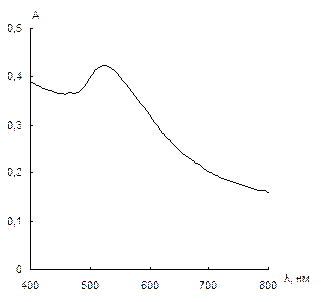 |
Рис. 2. Спектры поглощения водных растворов НЧ золота, стабилизированных цитратом натрия (а), цетилтриметиламмоний бромидом (б) и меркаптоэтанолом (в).
а б


Рис. 3. Электронная микрофотография (а) и электронограмма (б) наночастиц золота, стабилизированных цитратом натрия.
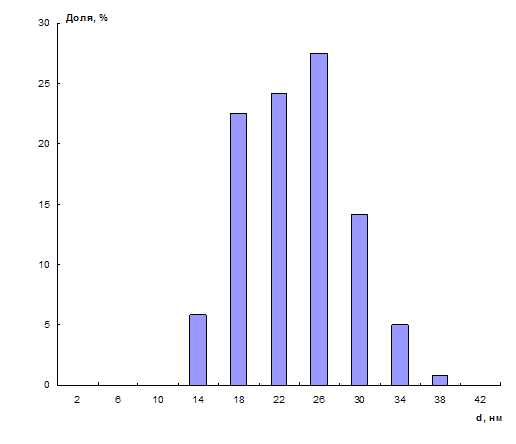
Рис. 4. Гистограмма распределения по размерам наночастиц золота, стабилизированных цитратом натрия.

Рис. 5. Электронная микрофотография наночастиц золота, стабилизированных цетилтриметиламмоний бромидом.
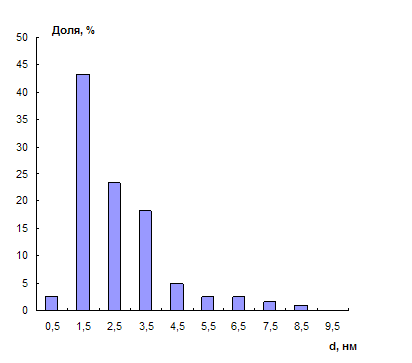
Рис. 6. Гистограмма распределения по размерам наночастиц золота, стабилизированных цетилтриметиламмоний бромидом.
3. АГРЕГАЦИЯ НАНОЧАСТИЦ ЗОЛОТА ПОД ВОЗДЕЙСТВИЕМ ТИОЛСОДЕРЖАЩИХ СОЕДИНЕНИЙ
3.1. Взаимодействие тиолсодержащих соединений с наночастицами золота, стабилизированными цитратом натрия
На первом этапе работы было изучено влияние природы тиолсодержащих соединений на агрегацию НЧ золота. Благодаря наличию в структуре этих соединений меркаптогруппы, все они могут сорбироваться на поверхности наночастиц золота, образуя прочную ковалентную связь Au – S.
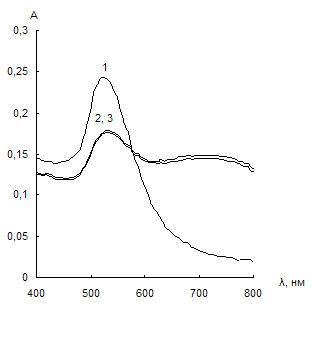
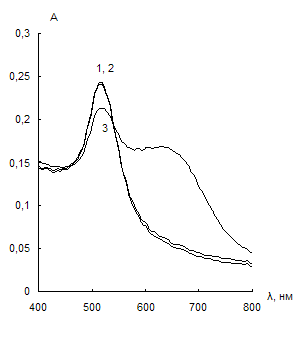
Использовали отрицательно заряженные наночастицы золота, синтезированные цитратным методом. На рис. 7 представлены спектры поглощения водных растворов НЧ в отсутствие (кривые 1) и в присутствии тиолсодержащих соединений (кривые 2). Из сравнения спектров поглощения видно, что из всех изученных соединений агрегацию НЧ золота вызывает только цистеамин, причем при достаточно низких концентрациях (0,03 мкг/мл). Агрегация сопровождается уменьшением полосы ППР при 525 нм и появлением полосы агрегатов при 750 нм. Напротив, цистеин, меркаптоэтанол и меркаптопропионовая кислота не вызывают агрегацию даже при концентрациях 100 мкг/мл.
Мы предполагаем, что наблюдаемое влияние тиолсодержащих соединений на агрегацию НЧ золота в первую очередь связано с их различным ионным состоянием. В условиях эксперимента (рН 4,5) органическое основание цистеамин (рКb = 3,7) находится в растворе в виде положительно заряженной протонированной формы, цистеин – в виде цвиттер-иона (рКа=2,1, рКb = 3,0), меркаптоэтанол – в виде нейтральной молекулы, а меркаптопропионовая кислота преимущественно в форме отрицательно заряженного аниона (рКа = 4,3).
Агрегация НЧ под воздействием цистеамина может быть описана схемой, представленной на рис. 8. В результате сорбции этого соединения на наночастицах золота не только уменьшается агрегативная устойчивость НЧ вследствие уменьшения заряда, но и появляется возможность их связывания за счет электростатического взаимодействия положительно заряженной аммониевой группы цистеамина на поверхности одной частицы с отрицательно заряженной
в г
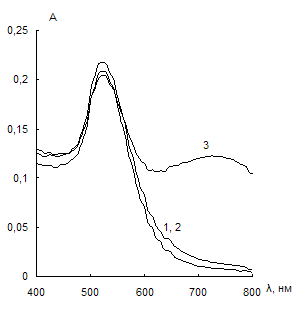
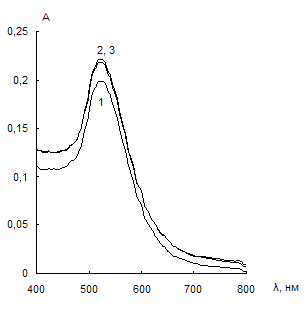
Рис. 7. Спектры поглощения водных растворов наночастиц золота в отсутствие тиолсодержащего соединения (1), в его присутствии (2), а также в присутствии тиолсодержащего соединения и 0,01 М ЭДТА (3).
сНЧ = 0,07 мМ, V = 10 мл, t = 2 мин.
а – цистеамин (с = 0,03 мкг/мл), б – цистеин (с = 100 мкг/мл (2), с = 0,2 мкг/мл (3)), в – меркаптоэтанол (с = 100 мкг/мл (2), с = 1 мкг/мл (3)), г – меркаптопропионовая кислота (с = 100 мкг/мл)
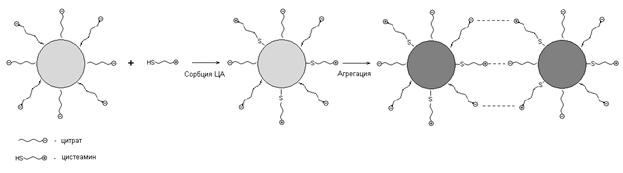
Рис. 8. Схема агрегации наночастиц золота под воздействием цистеамина
цитратной группой на поверхности другой. Оба эти эффекта способствуют агрегации наночастиц.
Из литературных данных известно, что агрегацию наночастиц золота, стабилизированных цитрат-ионами, могут вызывать многие положительно заряженные ионы: катионы металлов, катионные ПАВ, органические основания, тиолы и ряд других соединений. С целью устранения мешающего влияния катионов металлов нами было предложено вводить в раствор такой хорошо известный маскирующий агент как ЭДТА. Преимущества этого соединения состоят в прочности образующихся хелатов металлов, отсутствии у них окраски и, что особенно важно с точки зрения рассмотренного выше механизма агрегации НЧ, существовании комплексонатов металлов в виде анионов.
Спектры поглощения растворов НЧ золота в присутствии тиолсодержащих соединений и 0,01 М ЭДТА, вводимой в систему в виде тринатриевой соли, приведены на рис. 7 (кривые 3). Как видно из представленных данных, в присутствии ЭДТА наблюдается агрегация не только под воздействием цистеамина, но также меркаптоэтанола и цистеина. Этот эффект может являться следствием уменьшения стабильности коллоидной системы вследствие сжатия слоя противоионов вблизи поверхности наночастиц, обусловленного повышением ионной силы при добавлении ЭДТА. Подобные наблюдения описаны в литературе [76, 116, 117,] и начинают проявляться при ионной силе 10 – 40 мМ. Мы предполагаем, что наиболее значимую роль в этих процессах играет катион натрия, который проникая в плотный слой противоионов отрицательно заряженной наночастицы, уменьшает ее заряд и ζ-потенциал. Таким образом, уменьшается электростатическое отталкивание наночастиц и возрастает «чувствительность» системы к присутствию любых веществ, способных вызвать агрегацию.
Как и следовало ожидать, агрегации под действием меркаптопропионовой кислоты не наблюдается даже при введении в систему ЭДТА. Напротив, незначительное увеличение амплитуды полосы ППР в присутствии этого тиолсодержащего соединения может свидетельствовать об увеличении стабильности коллоидной системы, обусловленном более прочной сорбцией меркаптопропионат-ионов по сравнению с цитратом.
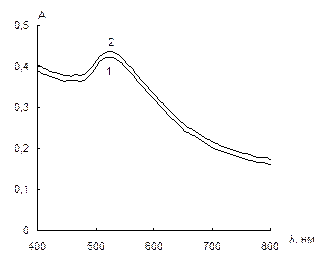
Влияние типа наночастиц золота. На примере цистеамина изучено взаимодействие с наночастицами золота, стабилизированными различными соединениями: цитратом натрия, ЦТМА и меркаптоэтанолом. Как уже упоминалось выше, наночастицы, синтезированные по цитратной методике, заряжены отрицательно, стабилизированные ЦТМА – положительно, а синтезированные в присутствии меркаптоэтанола – не заряжены. Из сравнения спектров поглощения, приведенных на рис. 9, видно, что агрегация под воздействием цистеамина наблюдается только для НЧ, синтезированных по цитратной методике. Это подтверждает описанный выше механизм агрегации НЧ. Для дальнейших исследований мы использовали НЧ этого типа.
Взаимодействие НЧ золота с цистеамином и цистеином изучено нами детально.
3.2. Влияние различных факторов на агрегацию наночастиц золота под воздействием цистеамина
Изучено влияние различных факторов на агрегацию наночастиц золота под воздействием цистеамина: концентрации ЭДТА, кислотности среды, концентрации наночастиц и цистеамина. О глубине протекания агрегации судили, сравнивая спектры поглощения, а также отношение оптических плотностей при длинах волн максимумов поглощения агрегатов и индивидуальных наночастиц А750/А525. Согласно литературным данным [66, 67, 80] это соотношение чаще всего используют для построения градуировочных графиков при определении ионов металлов и органических соединений. Рассмотрим влияние этих факторов последовательно.
а б
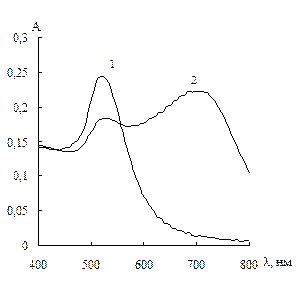
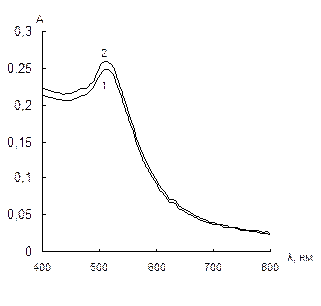
 в
в
Рис. 9. Спектры поглощения водных растворов наночастиц золота, стабилизированных цитратом натрия (а), цетилтриметиламмоний бромидом (б) и меркаптоэтанолом (в), в отсутствие (1) и в присутствии 0,4 мкг/мл цистеамина (2).
сНЧ = 0,07 мМ, V = 10 мл, t = 2 мин.
Влияние ЭДТА. Изучено взаимодействие НЧ золота с цистеамином в присутствии и в отсутствие ЭДТА. Как было сказано выше, это вещество вводится в систему в качестве маскирующего агента для устранения мешающего влияния ионов металлов. Из сравнения спектров поглощения НЧ золота при различных концентрациях тринатриевой соли ЭДТА, приведенных на рис. 10 (кривые 2 – 4), видно, что ЭДТА вплоть до концентрации 0,01 М не оказывает влияния на агрегацию наночастиц в присутствии 0,1 мкг/мл цистеамина, а, значит, может быть использована для маскирования ионов металлов. При концентрациях ЭДТА больших, чем 0,01М наблюдается частичная агрегация НЧ даже в отсутствие цистеамина (кривая 5), которую, как уже было описано выше, могут вызывать ионы натрия. Во всех дальнейших экспериментах была выбрана концентрация ЭДТА 0,005 М.
Влияние рН. Исследована зависимость агрегации наночастиц в присутствии цистеамина от рН раствора. Необходимую кислотность среды создавали при помощи растворов соляной кислоты и гидроксида натрия. Полученные зависимости представлены на рис. 11. Характер зависимости А750/А525 от рН в присутствии цистеамина и в его отсутствие, а также разности соотношения А750/А525 от рН указывает на то, что цистеамин вызывает агрегацию наночастиц в интервале рН 3 – 7. При рН < 3 наряду с цистеамином агрегацию наночастиц способны вызывать ионы водорода, а при рН > 7 агрегация уменьшается за счет частичного депротонирования цистеамина, а также увеличения степени диссоциации цитрат-ионов на поверхности наночастиц, что увеличивает их заряд и стабильность системы. В дальнейших экспериментах рН раствора поддерживали равным 7 – 8.
Влияние концентрации цистеамина. На рис. 12 приведены спектры поглощения водных растворов НЧ при различных концентрациях цистеамина. Как видно из представленных данных, с ростом концентрации ЦА наблюдается уменьшение полосы поверхностного плазмонного резонанса индивидуальных НЧ при 525 нм, появляется и увеличивается полоса поглощения при 750 нм, соответствующая агрегатам НЧ.
На рис. 13 приведена
зависимость отношения оптических плотностей растворов НЧ золота при длинах волн
750 и 525 нм от концентрации цистеамина, из которой видно, что цистеамин
вызывает агрегацию при концентрациях больших, чем 0,01 мкг/мл; соотношение А750/А525
практически линейно связано с
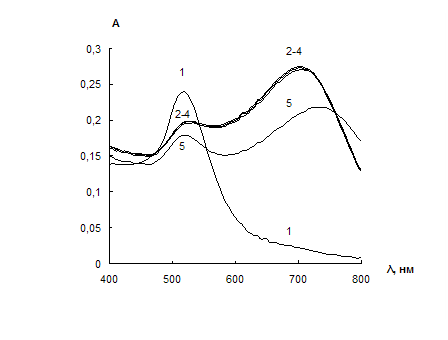
Рис. 10. Спектры поглощения водных растворов наночастиц золота в отсутствие (1) и в присутствии цистеамина и ЭДТА (2 – 5).
сНЧ = 0,07мМ; V = 10 мл; t = 2 мин;
сЦА, мкг/мл: 0 (1, 5); 0,1 (2 – 4);
сЭДТА, М: 0 (1, 2), 0,005 (3); 0,01 (4), 0,015 (5).
а б
Рис. 11. Зависимость соотношения А750/А525 от рН раствора в отсутствие (1) и в присутствии (2) 0,03 мкг/мл цистеамина (а) и соответствующая разность сигналов (б).
сНЧ
= 0,07мМ; V = 10 мл; t
= 2 мин.
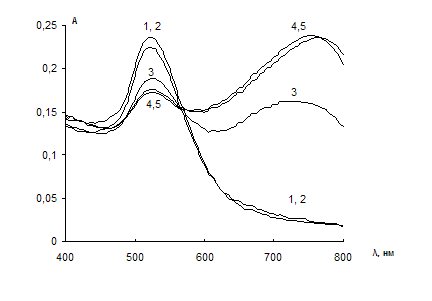
Рис. 12. Спектры поглощения водных растворов наночастиц золота в присутствии различных концентраций цистеамина.
сНЧ = 0,07мМ; V = 10 мл; t = 2 мин; сЭДТА = 0,005 М; рН 7,5;
сЦА, мкг/мл:0 (1); 0,01 (2); 0,03 (3); 0,05 (4); 0,1 (5).
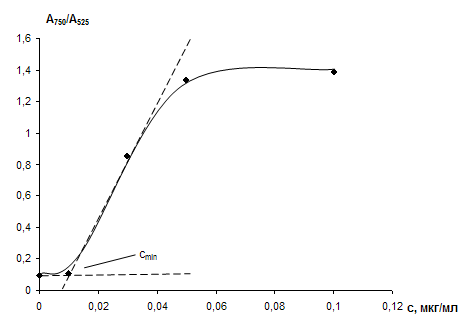
Рис. 13. Зависимость отношения оптических плотностей растворов наночастиц золота А750/А525 от концентрации цистеамина.
сНЧ = 0,07мМ; V = 10 мл; t = 2 мин; сЭДТА = 0,005 М; рН 7,5.
концентрацией цистеамина в интервале 0,01 – 0,05 мкг/мл. При концентрации цистеамина больше 0,05 мкг/мл наблюдается максимально достижимая в данных условиях агрегация наночастиц.
Влияние концентрации наночастиц золота. На рис. 14 приведены зависимости отношения оптических плотностей растворов НЧ золота А750/А525 от концентрации цистеамина для различных концентраций наночастиц: 0,07, 0,2 и 0,5 мМ. Зависимости имеют линейные участки, что можно использовать для спектрофотометрического определения цистеамина. Обнаружено, что при увеличении концентрации наночастиц диапазон определяемых содержаний цистеамина возрастает, но при этом снижается чувствительность методики (рис. 15, табл. 4). В табл. 4 приведены диапазоны определяемых содержаний и значения пределов обнаружения. Предел обнаружения рассчитывали подобно тому, как это делают в ионометрии – как точку пересечения линейных участков на зависимости отношения А750/А525 от концентрации цистеамина (рис. 13). По существу он отвечает той концентрации цистеамина, по достижении которой в системе наблюдается агрегация наночастиц, приводящая к изменению отношения А750/А525.
Полученные данные указывают на то, что метрологические характеристики спектрофотометрической методики определения цистеамина можно изменять, варьируя концентрацию наночастиц в анализируемом растворе. Однако дальнейшее снижение концентрации НЧ при их использовании в качестве спектрофотометрического реагента нецелесообразно, так как уменьшается величина измеряемого аналитического сигнала – оптической плотности.
Таблица 4. Диапазоны определяемых содержаний, пределы обнаружения и значения sr при определении цистеамина с использованием наночастиц золота с различной концентрацией (сЭДТА = 0,005 М, V = 10 мл, рН 7,5, n = 3, Р = 0,95)
|
сНЧ, мМ |
Диапазон определяемых содержаний, мкг/мл |
сmin, мкг/мл |
sr (с, мкг/мл) |
|
0,07 |
0,015 ‑ 0,05 |
0,01 |
0,05 (0,02) |
|
0,2 |
0,025 – 0,1 |
0,02 |
0,05 (0,05) |
|
0,5 |
0,05 – 0,2 |
0,03 |
0,03 (0,1) |
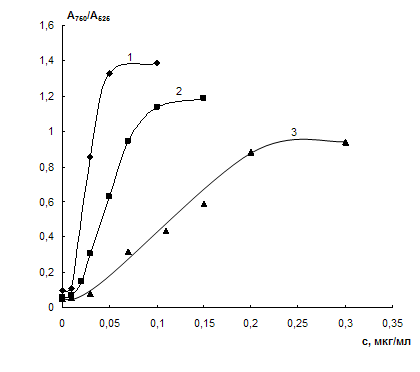
Рис. 14. Зависимость отношения оптических плотностей растворов наночастиц золота при длинах волн 750 и 525 нм (А750/А525) от концентрации цистеамина для различных концентраций наночастиц золота.
сЭДТА = 0,005 М, V = 10 мл, t = 2 мин. рН 7,5;
сНЧ , мМ: 0,07 (1); 0,2 (2); 0,5 (3).
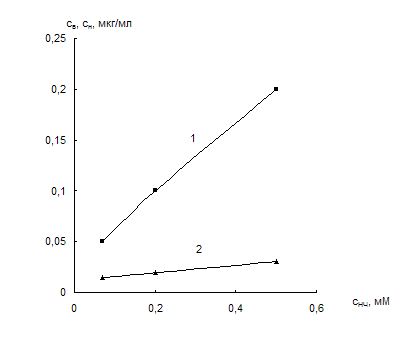
Рис. 15. Верхняя (1) и нижняя (2) границы диапазона линейности зависимостей А750/А525 – сЦА для различных концентраций наночастиц золота.
***
На основании анализа данных, приведенных в этом разделе, для спектрофотометрического определения цистеамина были выбраны следующие условия: сНЧ = 0,07 мМ, сЭДТА = 0,005 М, рН 7,5.
3.3. Влияние различных факторов на агрегацию наночастиц золота под воздействием цистеина
Влияние ЭДТА. Изучено взаимодействие НЧ золота с цистеином в присутствии различных концентраций ЭДТА. Из сравнения спектров поглощения, приведенных на рис. 16 видно, что в отличие от цистеамина цистеин вызывает агрегацию НЧ только в присутствии ЭДТА. Более того, как видно из сравнения спектров, концентрация ЭДТА в растворе должна быть достаточно высокой. Так, например, в присутствии 0,005 М ЭДТА агрегация НЧ не наблюдается даже, если концентрация цистеина равна 100 мкг/мл. Напротив, в присутствии 0,01 М раствора ЭДТА цистеин вызывает максимально возможную агрегацию уже при его концентрации 0,5 мкг/мл. Еще одно отличие связано со смещением на 50 нм полосы поглощения агрегатов в коротковолновую область: максимум поглощения полосы агрегатов находится при 700 нм. Во всех дальнейших экспериментах концентрация ЭДТА составляла 0,01 М.
Влияние рН. На рис. 17 приведены зависимости А700/А525 от рН в присутствии цистеина и в его отсутствие, а также разности отношения А700/А525 от рН. Из сравнения зависимостей видно, что цистеин вызывает максимальную агрегацию наночастиц в интервале рН 4 – 7.
Влияние концентрации цистеина. На рис. 18 приведены спектры поглощения водных растворов НЧ при различных концентрациях цистеина в присутствии 0,01 М ЭДТА. Как видно из представленных данных, с ростом концентрации цистеина наблюдается уменьшение полосы поверхностного плазмонного резонанса при 525 нм, появление полосы агрегатов и увеличение ее амплитуды по мере увеличения концентрации цистеина.
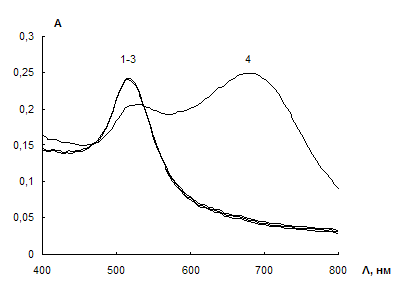
Рис. 16. Спектры поглощения водных растворов наночастиц золота в отсутствие (1) и в присутствии цистеина и ЭДТА (2 – 5).
сНЧ = 0,07мМ; V = 10 мл; t = 2 мин;
сЦ, мкг/мл: 0 (1); 100 (2, 3); 0,5 (4);
сЭДТА, М: 0 (1, 2), 0,005 (3); 0,01 (4).
а б
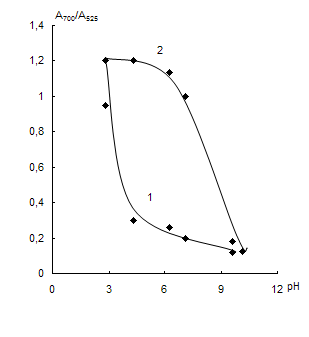
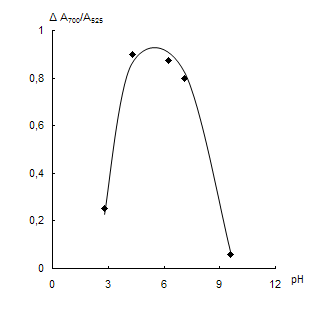
Рис. 17. Зависимость соотношения А700/А525 от рН раствора в отсутствие (1) и в присутствии (2) 0,2 мкг/мл цистеина и 0,01 М ЭДТА (а) и соответствующая разность сигналов (б).
сНЧ = 0,07мМ; V = 10 мл; t = 2 мин.
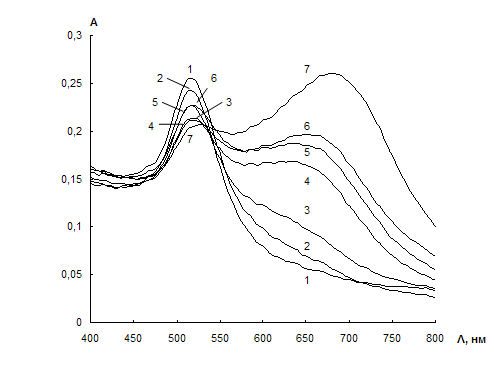
Рис. 18. Спектры поглощения водных растворов наночастиц золота в присутствии различных концентраций цистеина. сНЧ = 0,07мМ; V = 10 мл; t = 2 мин; сЭДТА = 0,01 М; рН 7,5;сЦ, мкг/мл:0 (1); 0,05 (2); 0,1 (3); 0,2 (4); 0,3 (5); 0,4 (6); 0,5 (7).
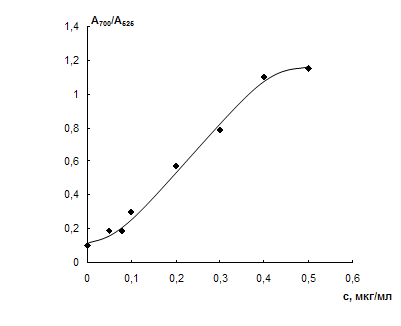
Рис. 19. Зависимость отношения оптических плотностей растворов наночастиц золота А700/А525 от концентрации цистеина. сНЧ = 0,07мМ; V = 10 мл; t = 2 мин.сЭДТА = 0,01М, рН 7,5.
Зависимость отношения оптических плотностей растворов НЧ золота при длинах волн 700 и 525 нм от концентрации цистеина приведена на рис. 19, из которого видно, что цистеин вызывает агрегацию при концентрациях больше 0,01 мкг/мл; отношение А700/А525 связано с концентрацией цистеина в интервале 0,05 – 0,5 мкг/мл. При концентрации цистеина больше 0,5 мкг/мл наблюдается максимально достижимая в данных условиях агрегация НЧ.
Влияние цистеамина. Из литературных данных известно, что порог агрегации наночастиц золота, стабилизированных цитратом, в присутствии органических соединений можно понизить за счет дополнительной функционализации НЧ фторсодержащим ПАВ [76], политимином [81] или цистеамином [83]. В рамках настоящей работы было обнаружено, что порог агрегации НЧ золота под воздействием цистеина удается понизить при введении в систему цистеамина. Из сравнения спектров, приведенных на рис. 20 видно, что при фиксированной концентрации цистеина (0,35 мкг/мл) амплитуда полосы поглощения агрегатов увеличивается при увеличении концентрации цистеамина от 0 к 0,005 и далее к 0,01 мкг/мл. Напротив, при фиксированной концентрации цистеамина (на рис. 21 приведены данные для сЦА= 0,01 мкг/мл) наблюдается появление полосы агрегатов и увеличение ее амплитуды по мере увеличения концентрации цистеина.
На рис. 22 приведены зависимости отношения оптических плотностей растворов НЧ золота при длинах волн 700 и 525 нм от концентрации цистеина в растворах с различной концентрацией цистеамина, из которых видно, что чем больше концентрация цистеамина в растворе, тем меньшие количества цистеина нужны для агрегации наночастиц. В табл. 5 приведены диапазоны определяемых содержаний и значения пределов обнаружения.
***
На основании анализа данных, приведенных в этом разделе, для спектрофотометрического определения цистеина были выбраны следующие условия: сНЧ = 0,07 мМ, сЭДТА = 0,01 М и рН 7,5.
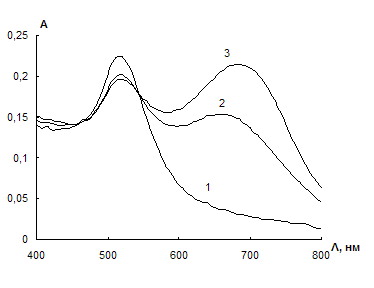
Рис. 20. Спектры поглощения водных растворов наночастиц золота в присутствии 0,35 мкг/мл цистеина и различных концентраций цистеамина.
сНЧ = 0,07мМ; V = 10 мл; t = 2 мин; рН 4,5;
сЦА, мкг/мл:0 (1); 0,005 (2); 0,01 (3).
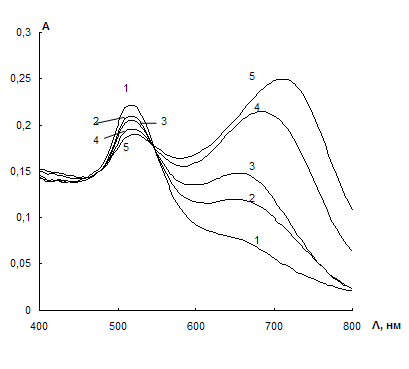
Рис. 21. Спектры поглощения водных растворов наночастиц золота в присутствии 0,01 мкг/мл цистеамина и различных концентраций цистеина.
сНЧ = 0,07мМ; V = 10 мл; t = 2 мин; рН 4,5;
сЦ, мкг/мл:0 (1); 0,15 (2); 0,2 (3); 0,35 (4); 0,5 (5).
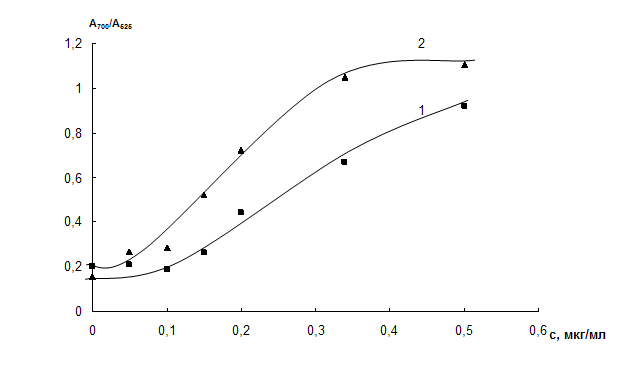
Рис. 22. Зависимость отношения оптических плотностей растворов наночастиц золота А700/А525 от концентрации цистеина в присутствии различных концентраций цистеамина.
сНЧ = 0,07 мМ, М, V = 10 мл, t = 2 мин.
сЦА, мкг/мл: 0,005 (1); 0,01 (2)
Таблица 5. Диапазоны определяемых содержаний, пределы обнаружения и значения sr при определении цистеина в присутствии различных количеств цистеамина (V = 10 мл, рН 4,5, n = 3, Р = 0,95)
|
Концентрация цистеамина, мкг/мл |
Диапазон определяемых содержаний, мкг/мл |
сmin ,мкг/мл |
sr |
|
0 |
– |
– |
– |
|
0,005 |
0,2 – 1 |
0,1 |
0,05 |
|
0,01 |
0,06 – 0,5 |
0,04 |
0,04 |
4. СОРБЦИЯ НАНОЧАСТИЦ ЗОЛОТА НА ПЕНОПОЛИУРЕТАНЕ
С целью расширения областей применения наночастиц золота в спектроскопических методах анализа в настоящей работе предполагалось изучить возможность применения ППУ, модифицированного наночастицами золота, в качестве твердофазного реагента для дальнейшего использования в спектроскопии диффузного отражения. Этот сорбент отличает высокая эффективность, химическая и механическая устойчивость, удобство в использовании, легкость отделения от других фаз, отсутствие собственной окраски, относительная дешевизна и доступность.
Установлено, что пенополиуретан сорбирует наночастицы золота из водных растворов, что сопровождается появлением в спектрах диффузного отражения ППУ полосы ППР при 530 нм и изменением окраски образцов из бесцветной в красно-фиолетовую.
Для получения пенополиуретана, модифицированного наночастицами золота сорбционным путем, таблетки ППУ помещали в водный раствор НЧ золота, стабилизированных цитрат-ионами. Их прожимали стеклянной палочкой для удаления воздуха из пор и встряхивали на механическом шейкере до достижения сорбционного равновесия. После чего окрашенные таблетки извлекали, высушивали между листов фильтровальной бумаги и измеряли спектр диффузного отражения.
Изучено влияние на сорбцию наночастиц золота пенополиуретаном различных факторов, таких как кислотность раствора, время контакта фаз и концентрация наночастиц.
Кислотность раствора. Изучена сорбция наночастиц золота на ППУ в зависимости от рН раствора (V = 10 мл, снч = 0,07 мМ, t = 20 мин). Для установления необходимого значения pH использовали соляную кислоту и гидроксид натрия. Полученная зависимость функции Кубелки-Мунка при 530 нм от рН представлена на рис. 23.
Максимальная сорбция НЧ золота на ППУ наблюдается в интервале pH 5 – 10. В области низких значений рН (меньше 5) происходит резкое понижение значения функции Кубелки-Мунка (F530), при этом в водном растворе наблюдается изменение окраски, свидетельствующее о протекании процесса агрегации наночастиц под воздействием ионов водорода. По-видимому, агрегаты НЧ золота сорбируются хуже, чем индивидуальные наночастицы. В области высоких значений рН (рН 10 – 12), сорбция наночастиц также падает, однако при этом процессов агрегации НЧ в растворе не наблюдается. Мы предполагаем, что подобный характер влияния рН в щелочной области на извлечение наночастиц ППУ может быть связан с особенностью строения последнего.
Структурная формула полимерного звена ППУ схематически может быть изображена следующим образом:
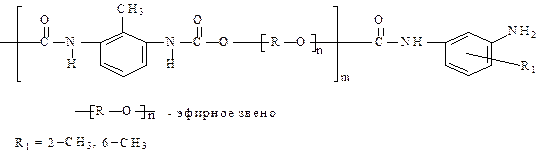
В состав полимерных звеньев пенополиуретана входят различные основные группы, такие как концевые толуидиновые, уретановые, а также амидные и мочевинные (на схеме не приведены), способные протонироваться в водных средах, вследствие чего поверхность ППУ заряжается положительно.
Наличие в составе ППУ протонированных участков должно способствовать сорбции наночастиц золота на его поверхности. Нисходящий характер рН-зависимости сорбции НЧ на ППУ в щелочной среде (рис. 23) подтверждает это предположение. Наряду с электростатическими взаимодействиями при сорбции НЧ золота на ППУ, по-видимому, реализуются и специфические за счет взаимодействия аминогрупп ППУ с поверхностными атомами золота, о чем свидетельствуют относительно высокие значения F530 даже при рН 12.
Время контакта фаз. Изучено влияние времени контакта фаз на сорбцию наночастиц золота ППУ. Зависимость степени извлечения НЧ от времени представлена на рис. 24, из которого видно, что сорбционное равновесие устанавливается в течение 15 – 20 мин. При этом достигается максимальная степень извлечения НЧ, равная 95 – 100%.
F pH
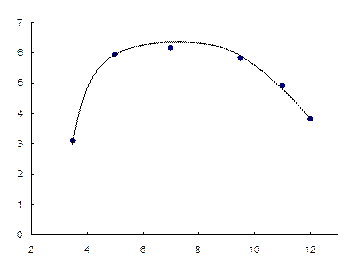

Рис.23. Влияние рН раствора на сорбцию наночастиц золота на ППУ.
сНЧ = 0,07 мМ, mППУ = 0,02 г, V = 10 мл, t = 20 мин.
R, % t,мин
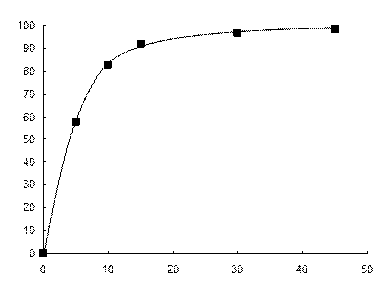

Рис. 24. Зависимость степени извлечения наночастиц золота на ППУ от времени контакта фаз.
сНЧ = 0,07 мМ, mППУ = 0,02 г, V = 10 мл, t = 20 мин.
Концентрация наночастиц. Исследовано влияние концентрации наночастиц золота на их сорбцию на ППУ. Сорбцию проводили из растворов с концентрацией НЧ, равной 0, 4,5, 9, 13,5, 18, 27 и 40,5 мкг/мл (0, 0,0235, 0,0465, 0,07, 0,095, 0,14 и 0,21 мМ). Установлено, что с ростом концентрации наночастиц в водном растворе функция Кубелки-Мунка при 530 нм возрастает, что свидетельствует об увеличении их содержания в матрице ППУ (рис. 25). Начальный участок зависимости линеен, а при концентрации наночастиц 20 – 25 мкг/мл график выходит на плато, которое отвечает предельной сорбции наночастиц (емкости сорбента). Максимальная сорбция НЧ составляет 10 мг/г сорбента.
Спектральные характеристики. Изучены спектральные характеристики ППУ, модифицированного наночастицами золота. На рис. 26 представлены нормированные спектры диффузного отражения ППУ, модифицированного НЧ, и поглощения исходного водного раствора наночастиц. Из рисунка видно, что при сорбции наночастиц золота на поверхности ППУ форма полосы поглощения НЧ в целом сохраняется, что свидетельствует о том, что принципиального изменения их состояния не происходит. Наблюдаемое небольшое батохромное смещение полосы ППР в фазе полимера (с 525 нм для водных растворов до 530 нм для модифицированного ППУ) и уширение ее длинноволновой части скорее всего связано с влиянием матрицы полимера на оптические свойства НЧ. Так, например, уширение может быть объяснено проявлением наноразмерных эффектов межчастичного взаимодействия, обусловленных более тесным расположением частиц на поверхности по сравнению с раствором, а также увеличением степени агрегации НЧ.
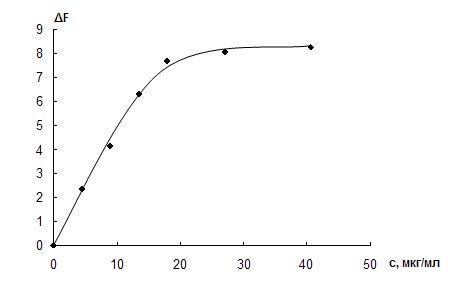
Рис. 25. Зависимость функции Кубелки-Мунка при 530 нм от концентрации наночастиц в водном растворе.
V = 10 мл, mППУ = 0,02 г, t = 20 мин, рН 4,5.
λ, нм 1 2
![]()
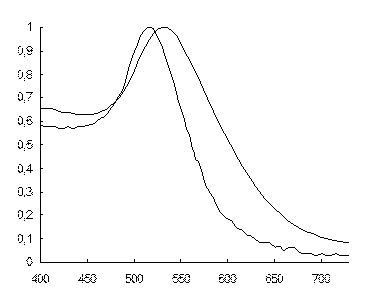
Рис. 26. Нормированные спектры диффузного отражения ППУ, модифицированного НЧ золота (1), и поглощения водного раствора наночастиц (2).
5. ПРИМЕНЕНИЕ ПЕНОПОЛИУРЕТАНА И НАНОЧАСТИЦ ЗОЛОТА ДЛЯ ОПРЕДЕЛЕНИЯ ЦИСТЕАМИНА
Изучение сорбции наночастиц золота на ППУ и их спектральных характеристик в матрице ППУ указывают на принципиальную возможность применения системы НЧ Au – ППУ в спектроскопии диффузного отражения. В рамках настоящей работы получены первые результаты, указывающие на то, что с применением ППУ и НЧ золота методом спектроскопии диффузного отражения можно определять цистеамин. Были предложены и разработаны три варианта использования ППУ и наночастиц золота для определения цистеамина (рис. 27).
Первый основан на использовании ППУ, модифицированного наночастицами золота, в качестве твердофазного реагента. Мы предполагали, что спектральные характеристики таблеток ППУ, модифицированных наночастицами золота, могут изменяться после контакта с водными растворами цистеамина вследствие протекания в матрице ППУ процессов агрегации.
Во втором варианте пенополиуретан предполагалось использовать для сорбции не только наночастиц, но и их агрегатов, образующихся в растворах под воздействием цистеамина, с последующим измерением диффузного отражения сорбатов. И, наконец, в третьем варианте с целью устранения мешающего влияния со стороны ионов металлов, присутствующих в реальных образцах, пенополиуретан использовали для сорбционного выделения цистеамина, после чего таблетку сорбента опускали в раствор, содержащий НЧ золота, и регистрировали глубину протекания процессов агрегации наночастиц в растворе спектрофотометрически.
В предварительных испытаниях было установлено, что ППУ, модифицированный НЧ золота, при контакте с водными растворами цистеамина не изменяет своих спектральных характеристик, что указывает на повышение агрегативной устойчивости наночастиц в матрице ППУ по сравнению с их водными растворами. Этот факт косвенно подтверждает высказанное выше предположение о наличии специфических взаимодействий между аминогруппами ППУ и поверхностными атомами золота. По-видимому, в процессе сорбции на ППУ НЧ золота, стабилизированных цитрат-ионами, наблюдается частичное или полное вытеснение цитрат-ионов, а стабилизация НЧ осуществляется за счет
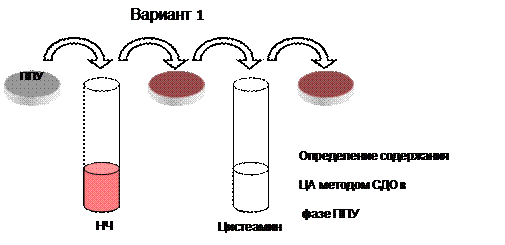
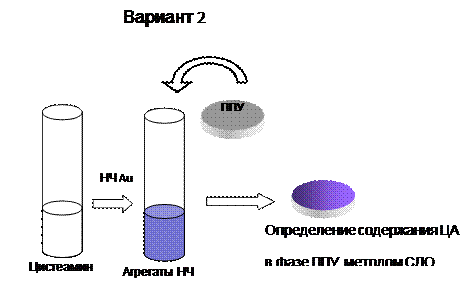
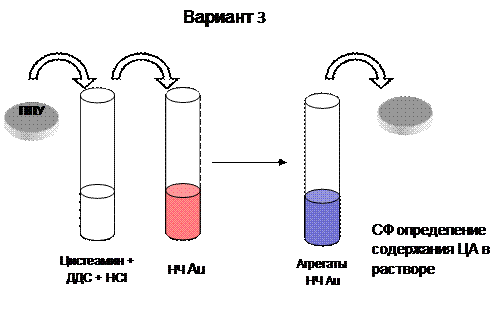
Рис. 27. Различные варианты применения пенополиуретана и наночастиц золота для определения цистеамина.
звеньев полимерных цепей ППУ. Полученные результаты указывают на невозможность реализации первого варианта.
В соответствии со вторым вариантом к растворам, содержащим различное количество цистеамина, добавляли фиксированное количество НЧ золота, после чего в раствор опускали по одной таблетке ППУ и осуществляли сорбцию НЧ или их агрегатов. Таблетку вынимали из раствора, просушивали между листами фильтровальной бумаги и измеряли спектры диффузного отражения.
Из сравнения спектров диффузного отражения образцов ППУ видно, что в отсутствие цистеамина наблюдается максимальная сорбция наночастиц золота (рис. 28, спектр 1). Спектры диффузного отражения образцов, полученных в условиях, когда в растворе присутствуют агрегаты НЧ (спектры 3 – 5), по форме повторяют спектр 1, но отличаются от него соотношением полос при 530 и 650 – 700 нм, что указывает на то, что агрегаты НЧ сорбируются на ППУ хуже, чем индивидуальные НЧ.
Наличие линейной зависимости в координатах F650/F530 – концентрация цистеамина в водном растворе (рис. 29) указывает на принципиальную возможность применения ППУ и наночастиц золота для определения этого соединения методом спектроскопии диффузного отражения.
Чувствительность методики можно повысить за счет увеличения объема анализируемого раствора. На рис. 29 приведена соответствующая зависимость, полученная после сорбции наночастиц и их агрегатов из 50 мл раствора (сНЧ=0,014 мМ), а в табл. 6 – диапазоны определяемых содержаний и значения cmin.
Таблица 6. Характеристики определения цистеамина с использованием пенополиуретана и наночастиц золота.
|
Вариант методики (СНЧ , мМ) |
Объем раствора, мл |
Диапазон определяемых содержаний, мкг/мл |
cmin, мкг/мл |
|
2 (0,07) |
10 |
0,015 ‑ 0,04 |
0,01 |
|
2 (0,014) |
50 |
0,0025 – 0,008 |
0,002 |
|
3 (0,07) |
10 |
0,2 – 0,4 |
0,15 |
Для реализации третьего варианта в пробирки для встряхивания, содержащие различные концентрации цистеамина, добавляли по 1 мл 0,01 М
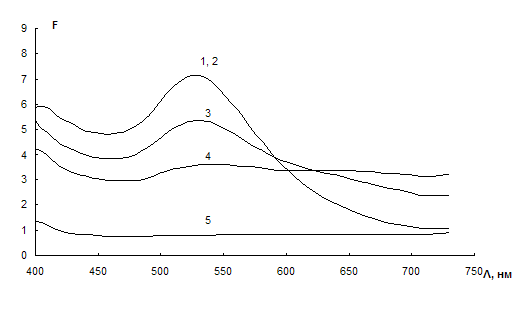
Рис. 28. Спектры диффузного отражения ППУ, модифицированного наночастицами золота в отсутствие (1) и в присутствии цистеамина (2 – 4)
СНЧ =0,07 мМ; V = 10 мл.
сЦА, мкг/мл: 0 (1), 0,01 (2), 0,02 (3), 0,03 (4), 0,04 (5).
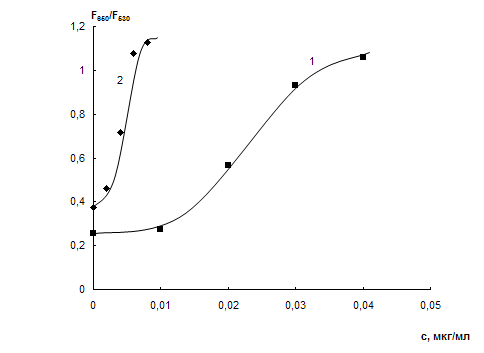
Рис. 29. Зависимость отношения F650/F530 от концентрации цистеамина после сорбции на ППУ наночастиц золота и их агрегатов из 10 (1) и 50 (2) мл раствора.
СНЧ , мМ: 0,07 (10 мл), 0,014 (50 мл)
раствора додецилсульфата натрия, по 0,2 мл 0,1 М раствора соляной кислоты и разбавляли водой до10 мл. Додецилсульфат натрия вводили в систему для перевода цистеамина в форму гидрофобного ионного ассоциата. Затем в каждую пробирку помещали по одной таблетке ППУ (mППУ = 0,02 г) и встряхивали содержимое пробирок на механическом шейкере в течение 60 мин. Таблетку ППУ с сорбатами цистеамина извлекали, прожимали фильтровальной бумагой и помещали в раствор НЧ с концентрацией 0,07мМ и общим объемом 10 мл и встряхивали в течение 30 мин. По истечении указанного времени наблюдали изменение цвета растворов, свидетельствующее о протекании процессов агрегации НЧ золота под воздействием цистеамина перешедшего в раствор с таблеток ППУ вследствие десорбции. Спектры поглощения водных растворов наночастиц золота после контакта с ППУ, модифицированным различным количеством цистеамина, приведены на рис. 30. На рис. 31 приведена зависимость отношения оптических плотностей растворов наночастиц золота А670/А525 от концентрации цистеамина после контакта с таблетками ППУ, из которой видно, что предлагаемый способ позволяет определять цистеамин в интервале его концентраций от 0,1 до 0,5 мкг/мл. Изменение диапазона определяемых содержаний в сторону больших концентраций цистеамина по-видимому связано с неколичественной сорбцией ассоциата ЦА:ДДС на ППУ. Как показали предварительные эксперименты, в описанных выше условиях он сорбируется на ППУ на 10 – 15%. Такой вариант методики в будущем целесообразно применять для анализа реальных образцов, содержащих относительное высокое содержание цистеамина. Его преимущество, отличающее его от второго варианта, заключается в устранении мешающего влияния со стороны ионов металлов, которые не сорбируются на ППУ.
Таким образом, на примере цистеамина мы показали, что ППУ и наночастицы золота можно использовать для определения органических соединений методом спектроскопии диффузного отражения. Кроме того, ППУ можно использовать для предварительного сорбционного выделения определяемых соединений и их последующего определения спектрофотометрическим методом.
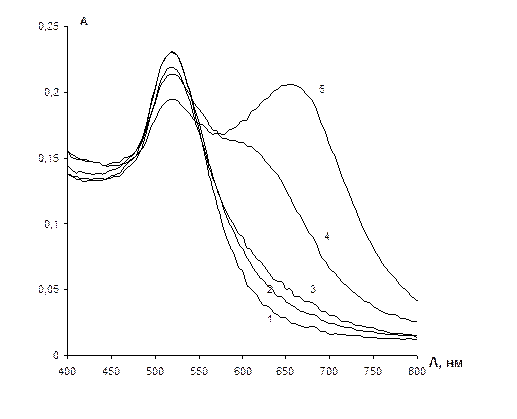
Рис. 30. Спектры поглощения водных растворов наночастиц золота после контакта с таблетками пенополиуретана, модифицированными различным количеством цистеамина.
сНЧ = 0,07 мМ; сЦА, мкг/мл: 0 (1); 0,11 (2); 0,22 (3); 0,33 (4); 0,44 (5).
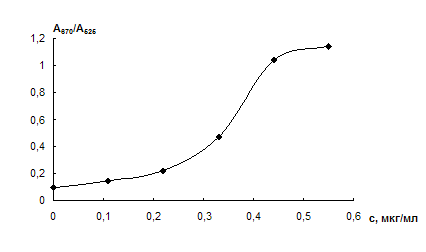
Рис. 31. Зависимость отношения оптических плотностей растворов наночастиц золота А650/А525 от концентрации цистеамина после контакта с таблетками ППУ. сНЧ = 0,07 мМ.
6. СПЕКТРОФОТОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ЦИСТЕАМИНА И ЦИСТЕИНА В РЕАЛЬНЫХ ОБЪЕКТАХ
6.1. Определение цистеамина
Для построения градуировочного графика в сосуды с притертыми пробками вводили от 0 до 0,5 мкг цистеамина, добавляли по 0,2 мл 0,25 М ЭДТА и 0,25 М NaOH, доводили до 10 мл деионизованной водой и вводили по 2 мл раствора золотых наночастиц с концентрацией 0,35 мМ. Через 2 мин после введения наночастиц снимали спектры поглощения растворов, рассчитывали отношение А750/А525. и стоили градуировочный график в координатах А750/А525 – концентрация цистеамина. Метрологические характеристики спектрофотометрической методики определения цистеамина приведены в табл. 7. Предел обнаружения равен 10 нг/мл.
Проведена оценка селективности методики. Установлено, что определению цистеамина не мешают, по крайней мере, 2000-кратные количества Na+ и K+, 1000-кратные – HCO3- SO42- и Cl- , 100-кратные – Ca2+, Mg2+, Mn2+, Fe3+, Cu2+, Zn2+. Сильное мешающее влияние, которое проявляется уже при сопоставимых количествах, оказывают цистеин, меркаптоэтанол (завышают результаты определения) и меркаптопропионовая кислота (занижает результаты определения) (табл. 8).
Правильность определения цистеамина подтверждена методом «введено – найдено» на модельных растворах, приготовленных на основе минеральной воды «Новотерская целебная» и питьевой негазированной воды «О!». Результаты определения, представленные в табл. 9, свидетельствуют о правильности и хорошей воспроизводимости методики.
Методика применена для определения цистеамина в средстве для биозавивки волос «Cutrin». В составе препарата «Cutrin» помимо цистеамина содержались вода, этаноламин, Oleth-20 (полиэтиленгликоль олеиловый эфир), аммония бикарбонат, отдушка, поливинилпирролидон и диэтилентриаминпентаацетат натрия.
Пробоподготовка препарата включала его последовательное разбавление деионизованной водой. Аликвоту разбавленного раствора препарата переносили в пробирки с притертыми пробками и проводили определение по методике, описанной выше.
Таблица 7. Характеристики спектрофотометрической методики определения цистеамина (n = 3, Р = 0.95)
|
Диапазон определяемых содержаний, мкг/мл |
сmin, мкг/мл |
sr (с, мкг/мл) |
Соотношение посторонних компонентов, не мешающих определению |
|
0,015 ‑ 0,05 |
0,01 |
0,05 (0,02) |
Na+, K+ – 2000; Ca2+, Mg2+, Mn2+, Fe3+, Cu2+, Zn2+ – 100, HCO3- SO42-, Cl- – 1000 |
Таблица 8. Результаты определения цистеамина в присутствии цистеина, меркаптоэтанола и меркаптопропионовой кислоты (n = 3, Р = 0,95)
|
Тиолсодержащее соединение (ТС) |
Соотношение ЦА:ТС |
Введено цистеамина, мкг/мл |
Найдено, цистеамина мкг/мл |
sr |
|
Цистеин |
1:1 |
0,03 |
0,050 ± 0,003 |
0,03 |
|
Меркаптоэтанол |
1:1 |
0,050 ± 0,004 |
0,05 |
|
|
Меркаптопропионовая кислота |
1:1 |
0,019 ± 0,001 |
0,03 |
Таблица 9. Результаты определения цистеамина в модельных растворах, приготовленных на основе минеральной и питьевой воды (n = 3, Р = 0,95)
|
Вода (состав, мг/л) |
Введено цистеамина, мкг/мл |
Найдено цистеамина, мкг/мл |
sr |
|
«Новотерская целебная» (Гидрокарбонат: 1000 –2000; сульфат: 900 – 1700; хлорид: 300 – 500; кальций: 300 – 400; магний<100; натрий+калий: 700 – 1200; кремниевая кислота: 30 – 90) |
0 0,03 |
0 0,035 ± 0,003 |
– 0,03 |
|
Питьевая негазированная «О!» (Гидрокарбонат: 80 –150; сульфат: 30 – 70; хлорид: 15 – 70; кальций: 25 – 60; магний:5 – 20; натрий+калий: 5 – 20)
|
0 0,03 |
0 0,029 ± 0,002 |
– 0,03 |
Полученный результат, приведенный в табл. 10, хорошо согласуется с результатом, полученным независимым методом (ВЭЖХ с амперометрическим детектором: колонка «Luna С18»; элюент – 35 % ацетонитрил, 65 % вода; скорость потока – 0,4 мл/мин; амперометрический детектор; потенциал +1 В).
Таблица 10. Результаты определения цистеамина в средстве для биозавивки волос «Cutrin» (n = 3, P = 0,95)
|
Спектрофотометрия |
ВЭЖХ |
||
|
Найдено, % |
sr |
Найдено, % |
sr |
|
10,7 ± 1,5 % |
0,06 |
11,9 ± 0,8. |
0,03 |
Методика применена для анализа модельного раствора, приготовленного на основе мочи. Моча собиралась у добровольца и хранилась при температуре -4ºС. Перед исследованием ее центрифугировали при 5000 об./мин в течение 15 мин, фильтровали через складчатый бумажный фильтр «Синяя лента». В пробирки с притертыми пробками вносили по 1,5 мл мочи и проводили определение по методике, описанной выше. Результаты определения, представленные в табл. 11, свидетельствуют о правильности результатов и хорошей воспроизводимости методики. Содержание цистеамина в анализируемом образце мочи составило (0,10 ± 0,04) мкг/мл. Согласно литературным данным, содержание цистеамина в моче здоровых людей колеблется от 0,1 до 1 мкг/мл [100].
Таблица 11. Результаты определения цистеамина в модельных растворах, приготовленных на основе мочи (n = 3, P = 0,95)
|
Введено ЦА, мкг/мл |
Найдено ЦА, мкг/мл |
sr |
|
0 |
0,10 ± 0,02 |
0,09 |
|
0,07 |
0,17 ± 0,03 |
0,06 |
|
0,13 |
0,26 ± 0,03 |
0,05 |
|
0,20 |
0,27 ± 0,03 |
0,05 |
6.2. Определение цистеина
Для построения градуировочного графика в сосуды с притертыми пробками вводили от 0 до 5 мкг цистеина, добавляли по 0,4 мл 0,25 М ЭДТА и 0,25 М NaOH, доводили до 10 мл деионизованной водой и вводили 2 мл раствора золотых наночастиц с концентрацией 0,35 мМ. Через 2 мин после введения наночастиц снимали спектры поглощения растворов. Метрологические характеристики спектрофотометрической методики определения цистеина и результаты оценки селективности приведены в табл. 12. Предел обнаружения равен 50 нг/мл.
Таблица 12. Характеристики спектрофотометрической методики определения цистеина (n = 3, Р = 0.95)
|
Диапазон определяемых содержаний, мкг/мл |
сmin, мкг/мл |
sr (с, мкг/мл) |
Соотношение посторонних компонентов, не мешающих определению |
|
0,06 ‑ 0,5 |
0,05 |
0,05 (0,2) |
Na+, K+ – 200; Ca2+, Mg2+, Mn2+, Fe3+, Cu2+, Zn2+ – 100, HCO3- SO42-, Cl- – 100
|
Правильность определения цистеина подтверждена методом «введено – найдено» на модельном растворе, приготовленном на основе питьевой негазированной воды «О!». В модельном растворе, содержащем 0,1 мкг/мл цистеина найдено 0,09 ± 0,02 мкг/мл (sr =0,10).
Как и в случае цистеамина, на определение цистеина сильное мешающее влияние, которое проявляется уже при сопоставимых количествах, оказывают цистеамин, меркаптоэтанол (завышают результаты определения) и меркаптопропионовая кислота (занижает результаты определения) (табл. 13). Определению не мешают, по крайней мере, 2-кратные количества метионина.
Проведено определение цистеина в лекарственном препарате «Перфалган», применяемом в качестве ненаркотического анальгетика, и пивных дрожжах.
Лекарственную форму препарата «Перфалган» (раствор для инфузий) разбавляли деионизованной водой в 100 раз. Для определения брали аликвотную часть этого раствора. Одну таблетку пивных дрожжей растворяли в 30 мл деионизованной воды в УЗ-ванне в течение 15 мин. Раствор фильтровали через складчатый фильтр в колбу емкостью 50 мл и доводили до метки деионизованной водой, после чего проводили серию разбавлений. Результаты представлены в табл. 14. Полученные результаты согласуются с данными, заявленными производителем.
Таблица 13. Результаты определения цистеина в присутствии цистеамина, меркаптоэтанола, меркаптопропионовой кислоты и метионина (n = 3, Р = 0,95)
|
Тиолсодержащее Соединение (ТС) |
Соотношение Ц:ТС |
Введено цистеамина, мкг/мл |
Найдено, цистеамина мкг/мл |
sr |
|
Цистеамин |
1:1 |
0,1 |
0,50 ± 0,06 |
0,05 |
|
Меркаптоэтанол |
1:1 |
0,15 ± 0,04 |
0,10 |
|
|
Меркаптопропионовая кислота |
1:1 |
0,010 ± 0,001 |
0,04 |
|
|
Метионин |
1:2 |
0,09 ± 0,02 |
0,09 |
Таблица 14. Результаты определения цистеина в препарате «Перфалган» и пивных дрожжах (n = 3, Р = 0,95).
|
Объект анализа |
Состав препаратов |
Найдено |
sr |
|
Перфалган (раствор для инфузий, UPSA) |
10 мг/мл парацетамола 38,5 мг/мл маннитола 0,25 мг/мл цистеина гидрохлорида моногидрата 0,13 мг/мл натрия гидрофосфата дигидрата
|
(0,23 ± 0,04) мг/мл |
0,08 |
|
Пивные дрожжи (ООО Экко Плюс) |
В одной таблетке пивных дрожжей содержатся: 80 мг L-метионина, 45 мг L-цистеина, 0,34 мг витамина В1, 0,15 мг витамина В2, 0,2 мг витамина В6, 1,5 мг ниацина, 27 мг фолиевой кислоты. Вспомогательные компоненты – микрокристаллическая целлюлоза, стеарат кальция. |
(43 ± 10) мг |
0,1 |
ВЫВОДЫ
1. Изучены особенности агрегации наночастиц золота в растворах в присутствии тиолсодержащих соединений: цистеамина, цистеина, меркаптоэтанола и меркаптопропионовой кислоты. Установлено, что агрегацию наночастиц золота, стабилизированных цитрат-ионами, вызывает только цистеамин. Показано, что по мере увеличения концентрации цистеамина, в спектрах поглощения растворов наночастиц золота наблюдаются изменения, проявляющиеся в уменьшении полосы поверхностного плазмонного резонанса при 525 нм, появлении и увеличении интенсивности полосы при 650 – 750 нм, соответствующей агрегатам наночастиц. Даны объяснения процессам агрегации в зависимости от природы тиолсодержащого соединения, типа наночастиц и их концентрации, рН раствора и ряда других факторов.
2. Изучены процессы агрегации наночастиц золота в присутствии тиолсодержащих соединений и ЭДТА, которую вводили в систему для маскирования катионов металлов. Показано, что в присутствии 0,005 – 0,01 М растворов ЭДТА наблюдается агрегация наночастиц под воздействием цистеамина, цистеина и меркаптоэтанола, что связано со снижением агрегативной устойчивости коллоидной системы за счет повышения ионной силы.
3. Обнаружен эффект снижения порога агрегации наночастиц золота под воздействием цистеина в присутствии цистеамина, что связано с дополнительной функционализацией наночастиц этим соединением.
4. Показано, что отношение оптических плотностей в максимумах поглощения агрегатов и индивидуальных наночастиц линейно связано с концентрацией цистеамина или цистеина в растворе, что может быть использовано для их спектрофотометрического определения с пределами обнаружения 0,01 и 0,05 мкг/мл соответственно.
5. Спектрофотометрические методики определения цистеамина и цистеина адаптированы при анализе реальных объектов. Проведено определение цистеамина в средстве для биозавивки волос «Cutrin» и моче, а цистеина – в лекарственном препарате «Перфалган» и пивных дрожжах.
6. Изучена сорбция наночастиц золота и их агрегатов на пенополиуретане. Показано, что количественная сорбция наночастиц достигается в интервале рН 5 – 10 через 20 мин контакта фаз. Установлено, что агрегаты наночастиц золота не сорбируются на пенополиуретане.
7. Обоснована принципиальная возможность применения пенополиуретана и наночастиц золота для определения цистеамина методом спектроскопии диффузного отражения с пределом обнаружения 0,002 мкг/мл.
1. Liu X., Atwater M., Wang J., Huo Q. Extinction coefficient of gold nanoparticles with different sizes and different capping ligands. // Colloids Surf. B. 2007. V. 58. P. 3 – 7.
2. Liu D., Wang Z., Jiang X. Gold nanoparticles for the colorimetric and fluorescent detection of ions and small organic molecules. // Nanoscale. 2011. V. 3. P. 1421 – 1433.
3. Sun Y., Xia Y. Gold and silver nanoparticles: A class of chromophores with colors tunable in the range from 400 to 750 nm. // Analyst. 2003. V. 128. P. 686 – 691.
4. Дыкман Л.А., Богатырев В.А., Щеголев С.Ю., Хлебцов Н.Г. Золотые наночастицы. Синтез, свойства, биомедицинское применение. М.: Наука, 2008. 319 с.
5. Дыкман Л.А., Богатырев В.А. Наночастицы золота: получение, функционализация, использование в биохимии и иммунохимии. // Успехи химии. 2007. V. 76. P. 199 – 213.
6. Merkoçi A., Aldavert M., Mann S., Alegret S. New materials for electrochemical sensing V: Nanoparticles for DNA labeling. // Trend. Anal. Chem. 2005. V. 24. P. 341 – 349.
7. Algar, W. R., Massey, M., Krull, U. J., The application of quantum dots, gold nanoparticles and molecular switches to optical nucleic-acid diagnostics. // Trend. Anal. Chem. 2009. V. 28. P. 292 – 306.
8. Cliffel D., Turner B.N., Huffman B.J. Nanoparticle-based biologic mimetics. // WIREs Nanomed. Nanobiotechnol. 2009. V. 1. P. 47 – 59.
9. Ghosh P., Han G., De M., Kim C.K., Rotello V.M. Gold nanoparticles in delivery applications. // Adv. Drug Deliver. Rev. 2008. V. 60. P. 1307 – 1315.
10. Patra C.R., Bhattacharya R., Mukhopadhyay D., Mukherjee P. Fabrication of gold nanoparticles for targeted therapy in pancreatic cancer. // Adv. Drug Deliver. Rev. 2010. V. 62. P. 346 – 361.
11. Pissuwan D., Niidome T., Cortie M.B. The forthcoming applications of gold nanoparticles in drug and gene delivery systems. // J. Control. Release. 2011. V. 149. P. 65 – 71.
12. Ghosh S.K., Pal T. Interparticle Coupling effect on the surface plasmon resonance of gold nanoparticles: from theory to applications. // Chem. Rev. 2007. V. 107. P. 4797 – 4862.
13. Saarinen J.J., Vartiainen E.M., Peiponen K.-E. Surface plasmon resonance reflectance from nanoparticles in a liquid matrix: Retrieval of the optical properties using the maximum entropy model. // Sensor. Actuat. B. 2009. V. 138. P. 383 – 395.
14. Uechi I., Yamada S. Photochemical and analytical applications of gold nanoparticles and nanorods utilizing surface plasmon resonance. // Anal. Bioanal. Chem. 2008. V. 391. P. 2411 – 2421.
15. Nguyen D.T., Kim D.-J., Kim K.-S. Controlled synthesis and biomolecular probe application of gold nanoparticles. // Micron. 2011. V. 42. P. 207 – 227.
16. Wang Z., M. Lina. Gold nanoparticle probes. // Coordin. Chem. Rev. 2009. V. 253. P. 1607 – 1618.
17. Yong K.-T., Swihart M.T., Ding H., Prasad P.N. Preparation of gold nanoparticles and their applications in anisotropic nanoparticle synthesis and bioimaging. // Plasmonics. 2009. V. 4. P. 79 – 93.
18. Treguer-Delapirre M., Majimel J., Mornet S., Duguet E., Ravaine S. Synthesis of non-spherical gold nanoparticles. // Gold Bull. 2008. V.41. № 2. P. 195 – 207.
19. Perez-Juste J., Pastoriza-Santos I., Liz-Marzan L.M., Mulvaney P. Gold nanorods: Synthesis, characterization and applications. // Coordin. Chem. Rev. 2005. V. 249. P. 1870 – 1901.
20. Sharma, V., Park, K., Srinivasarao, M., Colloidal dispersion of gold nanorods: Historical background, optical properties, seed-mediated synthesis, shape separation and self-assembly. // Mater. Sci. Eng. R. Rep. 2009. V. 65. P. 1 – 38.
21. Wang L., Li Y., Zhou L., Liu Y.-F., Meng L., Zhang K., Wu X., Zhang L., Chen C. Characterization of gold nanorods in vivo by integrated analytical techniques: their uptake, retention, and chemical forms. // Anal. Bioanal. Chem. 2010. V. 396. P. 1105 – 1114.
22. Guo S. J., Wang E. K., Synthesis and electrochemical applications of gold nanoparticles. // Anal. Chim. Acta. 2007. V. 598. P. 181–192.
23. Welch C.M., Compton R.G. The use of nanoparticles in electroanalysis: a review. // Anal. Bioanal. Chem. 2006. V. 384. P. 601 – 619.
24. Вертелов Г.К., Оленин А.Ю., Лисичкин Г.В. Применение наночастиц в электрохимическом анализе биологических объектов. // Журн. аналит. химии. 2007. Т. 62. № 9. C. 903 – 915.
25. Nilsson, C., Nilsson, S., Nanoparticle-based pseudostationary phases in capillary electrochromatography. // Electrophoresis. 2006. V. 27. P. 76 – 83.
26. Zhang, Z. X., Wang, Z. Y., Liao, Y. P., Liu, H. W. Application of nanomaterials in liquid chromatography: The opportunity for separation with high efficiency and selectivity. // J. Sep. Sci. 2006. V. 29. P. 1872 – 1878.
27. Sýkora D., Kašičkа V., Mikšik I., Řezanka P., Zăruba K., Matějka P., Král V. Application of gold nanoparticles in separation sciences. // J. Sep. Sci. 2010. V. 33. P. 372 – 387.
28. Guihen, E., Glennon, J. D. Nanoparticles in separation science – recent developments. // Anal. Lett. 2003. V. 36. P. 3309 – 3336.
29. Kist, T. B. L., Mandaji, M., Separation of biomolecules using electrophoresis and nanostructures. // Electrophoresis. 2004. V. 25. P. 3492 – 3497.
30. Nilsson, C.; Birnbaum, S.; Nilsson, S. Use of nanoparticles in capillary and microchip electrochromatography. // J. Chromatogr. A. 2007. V. 1168. P. 212 – 224.
31. С. Н. Штыков, Т. Ю. Русанова. Наноматериалы и нанотехнологии в химических и биохимических сенсорах: возможности и области применения. // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). 2008. Т. LII. № 2. С. 92 – 101.
32. Aslan K., Zhang J., Lakowicz J.R., Geddes C.D. Saccharide Sensing Using Gold and Silver Nanoparticles – A Review. // J. Fluoresc. 2004. V. 14. № 4. P. 391 – 400.
33. Standen R.-I.S., Standen J.F., Balasoiu S.-C., Vasile O.-R. Micro- and Nanosensors. Recent developments and features: A minireview. // Anal. Lett. 2010. V. 43. № 7. P. 1111 – 1118.
34. Haick H. Chemical sensors based on molecularly modified metallic nanoparticles. // J. Phys. D: Appl. Phys. 2007. V. 40. P. 7173 – 7186.
35. Guo S., Dong S. Biomolecule-nanoparticle hybrids for electrochemical biosensors. // Trend. Anal. Chem. 2009. V. 28. № 1. P. 96 – 109.
36. Seydack M. Nanoparticle labels in immunosensing using optical detection methods. // Biosens. Bioelectron. 2005. V. 20. P. 2454 – 2469.
37. Jans H. Huo Q. Gold nanoparticle-enabled biological and chemical detection and analysis. // Chem. Soc. Rev. 2012. V. 41. P. 2849–2866.
38. Agasti S.S., Rana S., Park M.-H., Kim C.K., You C.-C., Rotello V.M. Nanoparticles for detection and diagnosis. // Adv. Drug Deliver. Rev. 2010. V. 62. P. 316 – 328.
39. Zhang B., Yan B. Analytical strategies for characterizing the surface chemistry of nanoparticles. // Anal. Bioanal. Chem. 2010. V. 396. P. 973 – 982.
40. Daniel M-C., Astruc D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size related properties, and applications towards biology, catalysis and nanotechnology. // Chem. Rev. 2004. V. 104. P. 293 – 346.
41. Rosi N.L., Mirkin C.A. Nanostructures in biodiagnostics. // Chem. Rev. 2005. V. 105. P. 1547 – 1562.
42. Stewart M.E., Anderton C.R., Thompson L.B., Maria J., Gray S.K., Rogers J.A., Nuzzo R.G. Nanostructured plasmonic sensors. // Chem. Rev. 2008. V. 108 P. 494 – 521.
43. Levy R., Thanh N.T.K., Doty R.C., Hussain I., Nichols R.J., Schiffrin D.J., Brust M., Fernig D.G. Rational and combinatorial design of peptide capping ligands for gold nanoparticles. // J. Am. Chem. Soc. 2004. V. 126 P. 10076 – 10084.
44. Kumar S., Gandhi K.S., Kumar R. Modeling of formation of gold nanoparticles by citrate method. // Ind. Eng. Chem. Res. 2007. V. 46. P. 3128 – 3136.
45. Ji X., Song X., Li J., Bai Y., Yang W., Peng X. Size control of gold nanocrystals in citrate reduction: The third role of citrate. // J. Am. Chem. Soc. 2007. V. 129. P. 13939 – 13948.
46. Kimling J., Maier M., Okenve B., Kotaidis V., Ballot H., Plech A. Turkevich method for gold nanoparticle synthesis revisited. // J. Phys. Chem. B. 2006. V. 110. P. 15700 – 15707.
47. Burda C., Chen X., Narayan R., El-Sayed M.A. Chemistry and properties of nanocrystals of different shapes. // Chem. Rev. 2005. V. 105. № 4. P. 1025 – 1102.
48. Kelly K.L., Coronado E., Zhao L.L., Schatz G.C. The optical properties of metal nanoparticles: the influence of size, shape, and dielectric environment. // J. Phys. Chem. C. 2003. V. 107. P. 668 – 677.
49. Slocik J.M., Zabinski J.S Jr., Phillips D.M., Naik R.R. Colorimetric response of peptide-functionalized gold nanoparticles to metal ions. // Small. 2008. V. 4. № 5. P. 548 – 551.
50. Li D., Wieckowska A., Willner I. Optical analysis of Hg2+ ions by oligonucleotide–gold-nanoparticle hybrids and DNA-based machines. // Angew. Chem. Int. Ed. 2008. V. 47. P. 3927 – 3932.
51. Lee J.-S., Mirkin C.A. Chip-based scanometric detection of mercuric ion using DNA-functionalized gold nanoparticles. // Anal. Chem. 2008. V. 80. P. 6805 – 6808.
52. Chansuvarn W., Imyim A. Visual and colorimetric detection of mercury(II) ionusing gold nanoparticles stabilized with a dithia-diaza ligand. // MicrochimActa. 2012. V. 176. P. 57–64.
53. Liu J., Lu Y. Optimization of a Pb2+-directed gold nanoparticle/DNAzyme assembly and its application as a colorimetric biosensor for Pb2+. // Chem. Mater. 2004. V. 16. P. 3231 – 3238.
54. Lee Y.F. Huang C.C. Colorimetric Assay of Lead Ions in Biological Samples Using a Nanogold-Based Membrane. // ACS Appl. Mater. Interfaces. 2011. V. 3. P. 2747–2754.
55. Ying X., Zhao H., Wu Z., Li X., He Y., Yuan Z. Colorimetric detection of Cd2+ using gold nanoparticles cofunctionalized with 6-mercaptonicotinic acid and L-Cysteine. // Analyst. 2011. V. 136. P. 3725–3730.
56. Liu J.W., Lu Y. Colorimetric Cu2+ detection with a ligation DNAzyme and nanoparticles. // Chem. Commun. 2007. № 46. P. 4872 – 4874.
57. Wang L., Liu X., Hu X., Song S., Fan C. Unmodified gold nanoparticles as a colorimetric probe for potassium DNA aptamers. // Chem. Commun. 2006. № 36. P. 3780 – 3782.
58. Kim S., Park J.W., Kim D., Kim D., Lee I.H., Jon S. Bioinspired colorimetric detection of calcium(II) ions in serum using calsequestrin-functionalized gold nanoparticles. // Angew. Chem., Int. Ed. 2009. V. 48. P. 4138 – 4141.
59. Kalluri J.R., Arbneshi T., Khan S.A., Neely A., Candice P., Varisli B., Washington M., McAfee S., Robinson B., Banerjee S., Singh A.K., Senapati D., Ray P.C. Use of gold nanoparticles in a simple colorimetric and ultrasensitive dynamic light scattering assay: selective detection of arsenic in groundwater. // Angew. Chem., Int. Ed. 2009. V. 48. № 51. P. 9668 – 9671.
60. Wu Y., Zhan S., Wang F., He L., Zhi W., Zhou P. Cationic polymers and aptamers mediated aggregation of gold nanoparticles for the colorimetric detection of arsenic(III) in aqueous solution. // Chem. Commun. 2012. V. 48. P. 4459–4461.
61. Dang Y.Q., Li H.W., Wang B., Li L., Wu Y.Q. Selective detection of trace Cr3+ in aqueous solution by using 5,5′-dithiobis (2-nitrobenzoic acid)-modified gold nanoparticles. // ACS Appl. Mater. Interfaces. 2009. V. 1. № 7. P. 1533 – 1538.
62. Xin J., Miaо L., Chen S., Wu A. Colorimetric detection of Cr3+ using tripolyphosphate modified gold nanoparticles in aqueous solutions Anal. Methods .DOI: 10.1039/c2ay25061f. www.rsc.org/methods.
63. Li X.K., Wang J., Sun L.L., Wang Z.X. Gold nanoparticle-based colorimetric assay for selective detection of aluminium cation on living cellular surfaces. // Chem. Commun. 2010. V. 46. № 6. P. 988 – 990.
64. Li B.L., Du Y., Dong S.J. DNA based gold nanoparticles colorimetric sensors for sensitive and selective detection of Ag(I) ions. // Anal. Chim. Acta. 2009. V. 644. № 1 – 2. P. 78 – 82.
65. Kado S., Furui A., Akiyama Y., Nakahara Y., Kimura K. Application of gold nanoparticles to spectrophotometric sensing of hydrophilic anions based on molecular recognition by urea derivative. // Anal. Sci. 2009. V. 25. № 2. P. 261 – 265.
66. Tan F., Liu X., Quan X., Chen J., Li X., Zhao H. Selective detection of nanomolar Cr(VI) in aqueous solution based on 1,4-dithiothreitol functionalized gold nanoparticles. // Anal. Methods. 2010. DOI: 10.1039/c0ay00534g.
67. Watanabe S., Seguchi H., Yoshida K., Kifune K., Tadaki T., Shiozaki H. Colorimetric detection of fluoride ion in an aqueous solution using a thioglucose-capped gold nanoparticle. // Tetrahedron Lett. 2005. V. 46. P. 8827 – 8829.
68. Daniel W.L., Han H.S., Lee J.S., Mirkin C.A. Colorimetric nitrite and nitrate detection with gold nanoparticle probes and kinetic end points. // J. Am. Chem. Soc. 2009. V. 131. № 18. P. 6362 – 6363.
69. Kim M.H., Kim S., Jang H.H., Yi S., Seo S.H., Han M.S. A gold nanoparticle-based colorimetric sensing ensemble for the colorimetric detection of cyanide ions in aqueous solution. // Tetrahedron Lett. 2010. V. 51. P. 4712 – 4716.
70. Kubo Y., Uchida S., Kemmochi Y., Okubo T. Isothiouronium-modified gold nanoparticles capable of colorimetric sensing of oxoanions in aqueous MeOH solution. // Tetrahedron Lett. 2005. V. 46. № 25. P. 4369 – 4372.
71. Zhang Min, Liu Y.-Q., Ye B.-C. Colorimetric assay for sulfate using positively-charged gold nanoparticles and its application for real-time monitoring of redox process. // Analyst. 2011. V. 136. P. 4558 – 4562.
72. Lu Y., Liu J. Smart nanomaterials inspired by biology: dynamic assembly of error-free nanomaterials in response to multiple chemical and biological stimuli. // Acc. Chem. Res. 2007. V. 40. № 5. P. 315 – 324.
73. Lin Y.W., Huang C.C., Chang H.T. Gold nanoparticle probes for the detection of mercury, lead and copper ions.// Analyst. 2011. V. 136. P. 863-871.
74. Kuong C.-L., Chen W.-Y., Chen Y.-C. Semi-quantitative determination of cationic surfactants in aqueous solutions using gold nanoparticles as reporter probes. // Anal. Bioanal. Chem. 2007. V. 387. P. 2091 – 2099.
75. Rezanka P., Rezankova H., Matejka P., Kral V. The chemometric analysis of UV–visible spectra as a new approach to the study of the NaCl influence on aggregation of cysteine-capped gold nanoparticles. // Colloid. Surface. A: Physicochem. Eng. Aspects. 2010. V. 364. P. 94 – 98.
76. Lu C., Zu Y.B. Specific detection of cysteine and homocysteine: recognizing one-methylene difference using fluorosurfactant-capped gold nanoparticles. // Chem. Commun. 2007. № 37. P. 3871 – 3873.
77. Li L., Li B. Sensitive and selective detection of cysteine using gold nanoparticles as colorimetric probes. // Analyst. 2009. V. 134. P. 1361–1365.
78. Jiang Y., Zhao H., Zhu N.N., Lin Y.Q., Yu P., Mao L.Q. A simple assay for direct colorimetric visualization of trinitrotoluene at picomolar levels using gold nanoparticles. // Angew. Chem., Int. Ed. 2008. V. 47. № 45. P. 8601 – 8604.
79. Nara S., Tripathi V., Singh H., Shrivastav T.G. Colloidal gold probe based rapid immunochromatographic strip assay for cortisol. // Anal. Chim. Acta. 2010. V. 682. 66 – 71.
80. Guo L., Zhong J., Wu J., Fu F., Chen G., Zheng X., Lin S. Visual detection of melamine in milk products by label-free gold nanoparticles. // Talanta. 2010. V. 82. P. 1654 – 1658.
81. Qi W.J., Wu D., Ling J., Huang C.Z. Visual and light scattering spectrometric detections of melamine with polythymine-stabilized gold nanoparticles through specific triple hydrogen-bonding recognition. // Chem. Commun. 2010. V. 46. № 27. P. 4893 – 4895.
82. Roy B., Saha A., Nandi A. K. Melamine sensing through riboflavin stabilized gold nanoparticles. // Analyst. 2011. V. 136. P. 67–70.
83. Liang X., Wei H., Cui Z., Deng J., Zhang Z., You X., Zhang X.E. Colorimetric detection of melamine in complex matrices based on cysteamine-modified gold nanoparticles. // Analyst. 2011. V. 136. P. 179–183.
84. Reynolds R.A., Mirkin C.A., Letsinger R.L. A gold nanoparticle/latex microsphere-based colorimetric oligonucleotide detection method. // Pure Appl. Chem. 2000. V. 72. № 1 – 2. P. 229 – 235.
85. Zhang F.X., Han L., Israel L.B., Daras J.G., Maye M.M., Ly N.K., Zhong C.-J. Colorimetric detection of thiol-containing amino acids using gold nanoparticles. // Analyst. 2002. V. 127. P. 462 – 465.
86. Durocher S., Rezaee A., Hamm C., Rangan C., Mittler S., Mutus B. Disulfide-linked gold nanoparticle based reagent for detecting small molecular weight thiols. // J. Am. Chem. Soc. 2009. V. 131. № 7. P. 2475 – 2477.
87. Chavez J.L., Lyon W., Kelley-Loughanane N., Stone M.O. Theophylline detection using an aptamer and DNA-gold nanoparticle conjugates. // Biosens. Bioelectron. 2010. V. 26. P. 23 – 28.
88. Zhang J., Wang L.H., Pan D., Song S.P., Boey F.Y.C., Zhang H., Fan C.H. Visual cocaine detection with gold nanoparticles and rationally engineered aptamer structures. // Small. 2008. V. 4. № 8. P. 1196 – 1200.
89. Zhang Y.F., Li B.X., Chen X.L. Simple and sensitive detection of dopamine in the presence of high concentration of ascorbic acid using gold nanoparticles as colorimetric probes. // Microchim. Acta. 2010. V. 168. № 1 – 2. P. 107 – 113.
90. Wang J., Wang L.H., Liu X.F., Liang Z.Q., Song S.P., Li W.X., Li G.X., Fan C.H. A gold nanoparticle-based aptamer target binding readout for ATP assay. // Adv. Mater. 2007. V. 19. № 22. P. 3943 – 3946.
91. Jiang Y., Zhao H., Lin Y.Q., Zhu N.N., Ma Y.R., Mao L.Q. Colorimetric detection of glucose in rat brain using gold nanoparticles. // Angew. Chem., Int. Ed. 2010. V. 49. № 28. P. 4800 – 4804.
92. Li T., Zhu K., He S., Xia X., Liu S., Wang Z., Jiang X. Sensitive detection of glucose based on gold nanoparticles assisted silver mirror reaction. // Analyst. 2011. V. 136. P. 2893–2896
93. Zhang Y., Li B., Xu C. Visual detection of ascorbic acid via alkyne–azide click reaction using gold nanoparticles as a colorimetric probe. // Analyst. 2010. V. 135. P. 1579–1584.
94. Sun J., Ge J., Liu W., Fan Z., Zhang H., Wang P. Highly sensitive and selective colorimetric visualization of streptomycin in raw milk using Au nanoparticles supramolecular assembly. // Chem. Commun. 2011. V. 47. P. 9888–9890.
95. Liu D., Chen W., Wei J., Li X., Wang Z., Jiang X. A Highly Sensitive, Dual-Readout Assay Based on Gold Nanoparticles for Organophosphorus and Carbamate Pesticides. // Anal. Chem. 2012. V. 84. P. 4185−4191.
96. Weian Zhao, Michael A. Brook, and Yingfu Li. Design of Gold Nanoparticle-Based Colorimetric Biosensing Assays. // Chem. Bio. Chem. 2008. V. 9. P. 2363 – 2371.
97. Feksa L. R., Rech V. C., Silna Melo D. A., Wajner M., Dutra-Filho C. S., Souza Wyse A. T., Wannmacher C. M. D. Effects of cysteamine on oxidative status in cerebral cortex of rats. // Metab Brain Dis. 2008. V. 23. P. 81–93.
98. Schneider J.A., Clark K.E, Green A.A., Reisch J.S. , Markello T.C., Gahl W.A. , Thoene J.G. , Noonan P.K., Berry K.A. Recent advances in the treatment of cystinosis. // J. lnher. Metab. Dis. 1995. V. 18. P. 387-397.
99. Arican G. O. Cytoprotective effects of amifostine and cysteamine on cultured normal and tumor cells treated with paclitaxel in terms of mitotic index and 3H-thymidine labeling index. // Cancer Chemother Pharmacol. 2005. V. 56. P. 221–229.
100. Kataoka H., Tanaka H., Makita M. Determination of total cysteamine in urine and plasma samples by gas chromatography with flame photometric detection. // J. Chromatogr. B. 1994. V. 657. P. 9-13
101. Ogony J., Mare S., Wu W., Ercal N. High performance liquid chromatography analysis of 2-mercaptoethylamine (cysteamine) in biological samples by derivatization with N-(1-pyrenyl) maleimide (NPM) using fluorescence detection. // J. Chromatogr. B. 2006. V. 843. P. 57–62.
102. Kusmierek K., Glowacki R., Bald E. Determination of total cysteamine in human plasma in the form of its 2-S-quinolinium derivative by high performance liquid chromatography. // Anal Bioanal Chem. 2005. V. 382. P. 231–233.
103. Smolin L.A., Schneider J.A. Measurement of total plasma cysteamine using High-Performance Liquid Chromatography with electrochemical detection. // Anal Biochem. 1988. V. 168. P. 374-379.
104. Garcia R.A., Hirschberger L.L., Stipanuk M.H. Measurement of cysteamine in physiological samples by high performance liquid chromatography. // Anal Biochem. 1988. 170:432.
105. Raoof J.-B., Ojani R., Chekin F. Immobilization of 1,2-naphthoquinone-4-sulfonic acid on gold electrode: application for cysteamine detection using Michael addition. // J Mater Sci. 2009. V. 44. P. 2688–2693.
106. Cheng W. X., Peng D. Y., Lu C. H., Fang C. W. Direct Electrochemical Behavior of the Cysteamine/DNA/SWNTs-Film-Modified Au Electrode and Its Interaction with Taxol1. // Rus. J. Electrochem. 2008. V. 44. No. 9. P. 1052–1057.
107. Shahrokhian S. Lead Phthalocyanine as a Selective Carrier for Preparation of a Cysteine-Selective Electrode. // Anal. Chem. 2001. V. 73. P. 5972–5978.
108. Wang W., Rusin O., Xu X., Kim K.K., Escobedo J.O., Fakayode S.O., Fletcher K.A., Lowry M., Schowalter C.M., Lawrence C.M., Fronczek F.R.., Warner I.M., Strongin R.M., Detection of Homocysteine and Cysteine. // J. Am. Chem. Soc. 2005. V. 127. P. 15949– 15958.
109. Huang S., Xiao Q., Li R., Guan H.L., Liu J., Liu X.R., He Z.K., Liu Y. A simple and sensitive method for L-cysteine detection based on the fluorescence intensity increment of quantum dots. // Anal. Chim. Acta. 2009. V. 645. P. 73–78.
110. Nie L.H., Ma H.M., Sun M., Li X.H., Su M.H., Liang S.C. Direct chemiluminescence determination of cysteine in human serum using quinine–Ce (IV) system. // Talanta. 2003. V. 59. P. 959–964.
111. Lau C.W., Qin X.J., Liang J.Y., Lu J.Z. Determination of cysteine in a pharmaceutical formulation by flow injection analysis with a chemiluminescence detector. // Anal. Chim. Acta. 2004. V. 514. P. 45–49.
112. Wang H., Wang W.S., Zhang H.S. Spectrofluorimetic determination of cysteine based on the fluorescence inhibition of Cd (II)–8-hydroxyquinoline-5-sulphonic acid complex by cysteine. // Talanta. 2001. V. 53. P. 1015–1019.
113. Chwatko G., Bald E. Determination of cysteine in human plasma by high-performance liquid chromatography and ultraviolet detection after pre-column derivatization with 2-chloro-1-methylpyridinium iodide. // Talanta. 2000. V. 52. P. 509–515.
114. Sudeep P.K., Shibu Joseph S.T., Thomas K.G. Selective detection of cysteine and glutathione using gold nanorods. // J. Am. Chem. Soc. 2005. V. 127. P. 6516–6517.
115. Li Z. P., Duan X. R., Liu C. H. Du B. A. Selective determination of cysteine by resonance lightscattering technique based on self-assembly of gold nanoparticles. // Anal. Biochem.. 2006. V. 351. P. 18–25.
116. Wei X., Qi L., Tan J., Liu R., Wang F. A colorimetric sensor for determination of cysteine by carboxymethylcellulose-functionalized gold nanoparticles. // Anal. Chim. Acta. 2010. V. 671. P. 80–84
117. Hsiao Y.-P., Su W.-Y., Cheng J.-R., Cheng S.-H. Electrochemical determination of cysteine based on conducting polymers/goldnanoparticles hybrid nanocomposites. // Electrochim. Acta. 2011. V. 56. P. 6887 –6895.
118. Апяри В.В, Дмитриенко С.Г., Батов И.В. Золотов Ю.А. Мини-спектрофотометр Eye-One Pro как альтернатива спектрометру диффузного отражения. Журн. аналит. химии. 2011. Т. 66. № 2. С. 148 – 154.
119. Frens G. Controlled nucleation for the regulation of the particle size in monodispers gold suspensions. // Nat. Phys. Sci. 1973. V. 241. P. 20 – 22.
120. Andreu-Navarro A., Fernandez-Romero J.M., Gomez-Hens A. Determination of polyphenolic content in beverages using laccase, gold nanoparticles and long wavelength fluorimetry. // Anal. Chim. Acta. 2012. V. 713. P. 1 – 6.
121. Hsu C., Liou Y.-C. Frequency responses of Au nanoparticles in polyurethane resin. // Rev. Adv. Mater. Sci. 2005. V. 10. P. 325 – 330.
122. Li Z.P., Duan X.R., Liu C.H., Du B.N. Selective determination of cysteine by resonance light scattering technique based on self-assembly of gold nanoparticles. // Anal. Biochem. 2006. V. 351. P. 18 – 25.