УДК 543.4
ПРИМЕНЕНИЕ НАНОЧАСТИЦ ЗОЛОТА В СПЕКТРОФОТОМЕТРИИ
© 2013 г. В.В.
Апяри, В.В. Архипова, С.Г. Дмитриенко, Ю.А.Золотов
Московский государственный университет имени М.В. Ломоносова,
химический факультет
119992 Москва, ГСП-2, Ленинские горы д. 1 , стр. 3
2013 г
Обобщены и систематизированы
литературные данные о применении наночастиц золота в спектрофотометрии.
Приведены сведения о методах получения наночастиц золота и их оптических
свойствах. Обсуждены основные подходы, лежащие в основе спектрофотометрического
определения веществ с помощью наночастиц золота. Приведены примеры определения
ионов металлов, анионов и органических соединений.
Ключевые слова: наночастицы золота, поверхностный
плазмонный резонанс, спектрофотометрия
Число
публикаций по синтезу, исследованию свойств и применению наночастиц (НЧ)
золота увеличивается с каждым годом, что свидетельствует о значительном
интересе к этим нанообъектам со стороны исследователей, работающих в различных
областях науки (рис. 1). Обширную информацию о способах получения и
использованию НЧ золота в биохимии и биомедицине можно найти в монографии [1] и обзорах [2 – 10]. Систематизированы
данные о применении НЧ золота в электрохимическом и биоэлектрохимическом
анализе [11, 12], в хроматографических и
электрофоретических методах анализа [13, 14], для создания химических и
иммуносенсоров [15 – 19]. Исследованию свойств
НЧ металлов, в том числе и золота, аналитическими методами посвящен обзор [20].
В
настоящем обзоре систематизированы сведения об использовании наночастиц золота для
спектрофотометрического и визуально-колориметрического определения ионов
металлов, анионов и органических соединений, опубликованные преимущественно за период с 2007 по 2012 гг.
Общие сведения о методах получения наночастиц золота и их оптических свойствах
Несмотря
на то, что первая статья, посвященная методам синтеза и свойствам коллоидного золота,
была опубликована Майклом Фарадеем в 1857 г., это направление не утратило актуальности и в настоящее время. Основные усилия современных исследователей
направлены на получение наночастиц золота с различными размерами, формой и
узким распределением по размерам, на поиск новых веществ, способствующих их
стабилизации, на выявление связи размера, формы и свойств наночастиц с
выбранными восстановителями, стабилизаторами и условиями получения. Информация
о методах синтеза НЧ золота систематизирована в нескольких обзорах [1, 2, 5, 8, 16, 21, 22].
Для спектрофотометрического и визуально-колориметрического
определения ионов металлов, анионов и органических
соединений используют наночастицы золота сферической формы со средним диаметром
10 – 50 нм, которые получают химическим восстановлением
золотохлористоводородной кислоты. В качестве восстановителя чаще всего
используют цитрат натрия, боргидрид натрия, другие восстановители применяют реже.
Процесс
образования наночастиц протекает через ряд последовательных стадий:
возникновение отдельных атомов; зародышеобразование и формирование начального
атомного кластера; рост кластера до определенного размера; стабилизация
наночастиц (рис. 2). Размеры и
дисперсность формируемых наночастиц, а также их устойчивость во времени регулируют
варьированием природы стабилизатора и его количества. В качестве стабилизаторов
при синтезе монодисперсных НЧ золота используют избыток восстановителя, а также
специально вводимые вещества: ионогенные ПАВ, например, додецилсульфат натрия
или хлорид лаурилтриметиламмония, ионные жидкости, либо синтетические и
природные полимеры – поливинилпирролидон, полиэтиленгликоль, циклодекстрины,
хитозан и другие [2].
Наиболее популярным способом получения наночастиц золота является
метод Туркевича, основанный на восстановлении золотохлористоводородной кислоты
цитратом натрия, а также различные его модификации. Размер наночастиц от 10 до
150 нм можно контролировать, меняя соотношение между концентрациями цитрата
натрия (который в этом случае выполняет функцию не только восстановителя, но и
стабилизатора) и золотохлористоводородной кислотой. Для получения наночастиц
водный раствор HAuCl4
нагревают
до кипения, после чего добавляют цитрат натрия. Образование наночастиц
начинается со стадии быстрой нуклеации, после чего происходит их диффузионный
рост [5]. Средний диаметр частиц, получаемых цитратным методом, уменьшается при
увеличении концентрации цитрата в реакционной смеси [23, 24].
Интересную возможность
контроля размера наночастиц золота и получения более узкого распределения их по
размерам предоставляет техника выращивания затравок («seed-mediated
growth»). Ее суть состоит в
предварительном получении маленьких наночастиц золота, которые в дальнейшем
используют в качестве затравок для получения более крупных при введении их в
смесь HAuCl4
и восстановителя. Проведено систематическое исследование
роста наночастиц на затравках [25]. Установлено, что зависимость скорости роста
и размера синтезируемых наночастиц от концентрации HAuCl4 носит
немонотонный характер. При низких концентрациях HAuCl4
рост наночастиц на затравках ускоряется, а их
средний размер увеличивается с ростом содержания HAuCl4 в растворе.
При высоких концентрациях HAuCl4 наблюдается быстрое образование
зародышей, что приводит к уменьшению среднего диаметра наночастиц и увеличению
полидисперсности. Таким образом, закономерности роста наночастиц золота не
противоречат классической теории образования осадков.
В основе уникальных
оптических свойств наночастиц золота лежит явление поверхностного плазмонного
резонанса (ППР) (иногда, применительно к наночастицам, говорят о
локальном или локализованном поверхностном плазмонном резонансе) [1, 2, 8, 21,
22].
Оно возникает как следствие коллективного поведения делокализованных электронов
проводимости на поверхности частицы, которое проявляется во взаимодействии с
внешними электромагнитными полями. Это приводит к появлению в спектрах
поглощения максимумов, отвечающих наступлению условий резонанса при совпадении
частоты электромагнитного излучения с собственной частотой колебаний
поверхностных плазмонов. Такие колебания называют плазмонными, а резонанс –
поверхностным плазмонным резонансом.
Поскольку для
наночастиц характерна высокая доля поверхностных атомов, положение и форма
полосы ППР сильно зависят от локальной диэлектрической проницаемости среды
вблизи поверхности. Поэтому любое изменение в
окружении частиц (поверхностное модифицирование, агрегация, изменение
показателя преломления среды и др.) приводит к изменению их оптических свойств
[26].
Так, например, если частицы формируют агрегаты, то в результате
диполь-дипольных взаимодействий полоса ППР смещается в сторону больших длин
волн и уширяется (рис. 3). Для сферических наночастиц золота в водном растворе
полоса ППР лежит в видимой области спектра. Положение ее максимума зависит от
среднего размера наночастиц и смещается в область больших длин волн с ростом
диаметра частиц [21, 27] (рис. 4). На эффектах влияния размера и формы
наночастиц на их оптические характеристики основаны различные способы оценки
геометрических параметров наночастиц по спектрам поглощения их растворов [28].
Наиболее сильно влияет
на полосу ППР наночастиц золота их агрегативное состояние. Агрегация наночастиц
золота приводит к контрастному изменению цвета растворов с рубиново-красного на
фиолетовый или синий (в зависимости от размера агрегатов). На эффекте изменения
степени агрегации основано большинство известных на сегодняшний день оптических
сенсоров на основе наночастиц золота и спектрофотометрических методик.
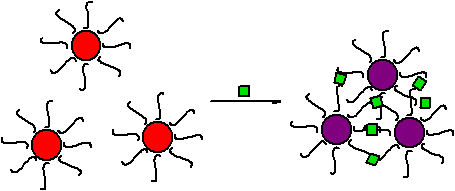
Выделяют два типа
агрегации с участием наночастиц золота – агрегация со сшиванием (crosslinking
aggregation) и агрегация без
сшивания (non-crosslinking
aggregation) (рис. 5). В первом
случае молекулы определяемых соединений связываются с модификаторами на
поверхности двух или более наночастиц, в результате чего происходит сшивка и
агрегация НЧ. Во втором случае определяемое соединение удаляет или замещает
модификатор на поверхности наночастиц и вызывает, таким образом, дестабилизацию
коллоидной системы (рис. 5).
Основными факторами, свидетельствующими
в пользу применения наночастиц золота в спектрофотометрии, являются
относительная простота получения, высокие молярные коэффициенты поглощения, а
также практически неограниченная возможность регулирования спектральных
характеристик наночастиц изменением их размеров, формы и химического окружения.
Основное отличие
наночастиц золота от традиционных спектрофотометрических реагентов, для которых
возникновение или изменение окраски является следствием изменения электронного
состояния реагента или определяемого соединения в результате их
непосредственного взаимодействия, состоит в возможности изменения оптических
характеристик наночастиц только вследствие их агрегации в присутствии
определяемого компонента. Иными словами, не важны хромофорные свойства молекул
модификатора, определяемого компонента и продуктов их взаимодействия. Возможность
функционализации поверхности наночастиц различными по своей природе и
химическим свойствам модификаторами и отсутствие каких-либо требований к их
хромофорным свойствам позволяет синтезировать чувствительные и селективные
реагенты на основе наночастиц для определения широкого круга соединений. Наиболее
целесообразным кажется использование таких реагентов при определении
соединений, не имеющих хромофорных групп, или получение окрашенных производных которых затруднено.
Стратегия применения наночастиц золота в спектрофотометрическом
анализе в большинстве случаев сводится к следующему: к раствору определяемого
компонента добавляют определенное количество предварительно синтезированных НЧ
золота и регистрируют изменения оптических характеристик анализируемых
растворов спектрофотометрически или визуально. В случае спектрофотометрического
определения, как правило, регистрируют изменение оптической плотности при длине
волны максимума поглощения индивидуальных наночастиц (520 – 530 нм) или их
агрегатов (600 – 800 нм), либо вычисляют соотношение этих величин,
характеризующее степень агрегации наночастиц.
С использованием наночастиц золота можно определять ионы металлов,
анионы и органические соединения. Рассмотрим принципы, лежащие в основе
подобного рода методик.
Определение ионов металлов
Описано использование
наночастиц золота для спектрофотометрического определения ртути [29 – 62],
свинца [29, 38, 47, 54, 63 – 69], хрома [70 – 75], меди [54, 76 – 80], серебра
[31, 45, 47, 81], кальция [82 – 84], мышьяка [85 – 87], магния [84], алюминия [88],
калия [89], железа [90], кобальта [29], кадмия [91], платины и палладия [29],
лантаноидов [92], урана [93].
В большинстве случаев
определение основано на образовании координационных связей между ионами металла
и модификаторами наночастиц. Поэтому выбор модификатора важен в регулировании
чувствительности и селективности определения. Вследствие
взаимодействия иона металла с молекулами модификатора, находящимися на
поверхности наночастиц золота, чаще всего происходит «сшивание» НЧ, что
приводит к их агрегации. В большинстве случаев для определения
ионов металлов используют наночастицы золота, модифицированные ДНК [37, 53, 80,
81], пептидами [29, 64, 82, 88], меркаптосоединениями [37, 70, 75, 85, 86, 91].
Для определения ионов металлов использовали НЧ, модифицированные пептидом [29].
Интересно отметить, что наблюдаемое изменение окраски изначально окрашенных в
рубиновый цвет наночастиц золота зависит от определяемого иона металла. Так, в
присутствии ртути она становится сине-фиолетовой, свинца – сине-зеленой,
кобальта – коричневой, палладия – вишневой, платины – грязно-фиолетовой.
Пределы обнаружения металлов находятся на уровне 20 – 200 нМ.
Среди всех металлов,
определение которых описано в литературе, наибольшее внимание уделяется ртути и
свинцу. Этот интерес, по-видимому, во многом обусловлен не только актуальностью
определения данных металлов в следовых количествах, но и их высоким сродством к
молекулам-модификаторам, в результате чего агрегация наночастиц золота
наблюдается при низких концентрациях этих ионов. Описаны методики спектрофотометрического
определения ртути, основанные на использовании НЧ золота, модифицированных ДНК;
пределы обнаружения ртути составляют 100 – 1000 нМ. [56 – 58]. Ионы
ртути участвуют в формировании связей между тиминовыми основаниями ДНК на
поверхности двух разных наночастиц, что приводит к их связыванию и повышению
температуры разрушения агрегатов; в результате чего НЧ остаются в
агрегированном состоянии, в то время как в отсутствие ртути при той же
температуре агрегаты уже разрушаются. Достоинством методик
является высокая селективность, обусловленная комплементарными взаимодействиями,
недостатками – необходимость точного контроля температуры, а также трудности в
работе с ДНК и ее относительно высокая стоимость.
Описан ряд способов
определения ртути, основанных на агрегации НЧ, модифицированных ДНК, без сшивания.
Для модифицирования НЧ, как правило, используют короткоцепочечные одно- или двунитевые
молекулы ДНК, которые сорбируются на поверхности наночастиц и стабилизируют их
за счет электростатического отталкивания. Катионы ртути, связываясь с
тиминовыми основаниями ДНК, вызывают удаление (десорбцию) ее молекул с поверхности
наночастиц, вызывая тем самым их агрегацию [59 –
62]. Способ позволяет определять ртуть на уровне нМ. Еще один пример основан на
применении положительно заряженных НЧ золота, модифицированных хлоридом
(11-меркаптоундецил)триметиламмония [48]. Введение в раствор, содержащий такие
наночастицы, ионов ртути способствует разрушению связей Au
–
S между
поверхностными атомами золота и молекулами модификатора, десорбции последних и
агрегации НЧ. Установлено, что реакция ускоряется при действии света. Предел
обнаружения ртути составляет 30 нМ. Способ использовали для определения ртути в
питьевой воде.
В ряде
случаев в результате взаимодействия иона металла с молекулами модификатора,
находящимися на поверхности наночастиц золота, наблюдается эффект, обратный
агрегации – пептизация или «антиагрегация», вызванный их дополнительной
стабилизацией. Для определения свинца использовали наночастицы,
модифицированные ДНК, при этом в систему вводили молекулы другой ДНК,
содержащие участки, комплементарные ДНК-модификатору, а также «центры разрыва» –
мутации, способные легко разрушаться в присутствии ионов свинца [63]. Разрыв
молекул ДНК в местах мутаций препятствовал вызывающему агрегацию наночастиц
золота образованию связанной комплементарными взаимодействиями двунитевой
структуры. Поэтому в присутствии ионов свинца наночастицы при нагревании
переходят из агрегированного состояния в свободное намного легче, чем в
отсутствие. При этом цвет раствора изменяется с синего на рубиново-красный, на
чем и основано определение. С помощью описанного способа можно определять свинец
с пределом обнаружения 100 нМ [63].
Более полную информацию
о методах определения ионов ртути, свинца, а также меди можно найти в обзоре [54].
Другие примеры использования наночастиц золота для определения ионов
металлов приведены в табл. 1.
Определение
анионов
С использованием наночастиц золота разработаны методики
спектрофотометрического и визуально-колориметрического определения дигидро- [94,
95] и гидрофосфат-ионов [96], фторида [97, 98], цианида [99], нитрита [100],
сульфата [101], сульфида [102] и гипохлорита [103]. Характеристики определения
анионов с использованием наночастиц золота приведены в табл. 2. В большинстве
описанных методик в результате взаимодействия анионов с модификаторами
наночастиц наблюдалась агрегация. В зависимости от природы модификатора и
определяемого иона взаимодействие может протекать по ионообменному, донорно-акцепторному
или окислительно-восстановительному механизмам.
Так, ионный обмен между гидрофильными и гидрофобными
анионами был использован для обнаружения фторида после переведения в
трифторфенилборат [98]. Использовали наночастицы, стабилизированные бромидом
производного изотиурония [бис(5-(N-(2-(2-метокиэтокси)этил)-N-метил-S-изотиуронио)пентил)дисульфида].
При обмене бромида на трифторфенилборат наблюдали гидрофобизацию наночастиц и
их последующую агрегацию.
Интересный способ определения нитрит-ионов описан
в работе [100]. Использовали смесь наночастиц двух типов –
функционализированных анилиновыми и нафтиламиновыми фрагментами. В присутствии
нитрит-ионов протекает реакция Грисса, приводящая к образованию азосоединения,
выполняющего роль ковалентной сшивки между наночастицами. Способ
характеризуется хорошей селективностью и позволяет определять нитрит-ионы с
пределом обнаружения 22 мкМ. Методика применена для определения нитрит-ионов в
природных водах.
Еще один подход к определению анионов описан в
работе [94]. Для определения дигидрофосфат-ионов использовали наночастицы
золота, модифицированные фенилмочевиной. В рассматриваемом случае NH-группы фенилмочевины
играют роль доноров протонов, в то время как дигидрофосфат является их
акцептором. Взаимодействие аниона с НЧ препятствует образованию водородных
связей между наночастицами, что вызывает антиагрегацию НЧ и увеличение интенсивности
полосы ППР при 510 нм. Вследствие гидрофобности функционализированных НЧ способ
неприменим для анализа водных растворов, но перспективен для определения дигидрофосфата
в неполярных средах.
В основу спектрофотометрического определения
дихромат-ионов положена окислительно-восстановительная реакция [75].
Определение основано на окислении дихромат-ионами меркаптогрупп в молекулах модификатора
–дитиотреитола, протекающем с образованием дисульфидной связи между отдельными
наночастицами. В данном случае анион не участвует непосредственно в
формировании связей между НЧ золота, а лишь создает условия для их образования.
Предел обнаружения дихромата равен 20 нМ. Методика пригодна для определения дихромата
в природных водах.
Определение
низкомолекулярных органических соединений
В отличие от ионов
металлов и анионов для определения органических соединений часто используют
наночастицы золота, стабилизированные цитрат-ионами (их также называют
немодифицированными, label-free).
Определение основано на том, что определяемое органическое соединение,
сорбируясь на таких наночастицах, приводит к уменьшению отрицательного заряда
их поверхности и вызывает агрегацию. Так, описан способ полуколичественного
определения катионных ПАВ [104]. Авторы предполагают, что при концентрациях ПАВ
меньше ККМ они адсорбируются на отрицательно заряженных наночастицах, вызывают
их гидрофобизацию и агрегацию, что приводит к изменению цвета с рубинового на
сине-фиолетовый. При концентрациях больше ККМ наблюдается восстановление рубиновой
окраски растворов, что связывают с образованием мицелл, где
наночастицы находятся на их гидрофильной поверхности. Нам, однако, кажется
маловероятным образование подобных структур в силу относительно большой массы и
размеров наночастиц золота. Более адекватный, на наш взгляд, механизм
восстановления оптических характеристик растворов включает инкапсуляцию
гидрофобизированных НЧ золота в неполярные полости мицелл ПАВ и, как следствие,
их перезарядку. Описанный подход основан на использовании
взаимодействий двух типов – электростатических и гидрофобных, – что делает его
универсальным для определения различных КПАВ и оценки их суммарного содержания.
Необходимо отметить, что неионогенные и анионные ПАВ не вызывают агрегацию
наночастиц золота.
Еще один пример
визуально-колориметрического определения, основанный на использовании
немодифицированных НЧ золота, применительно к тиолсодержащим аминокислотам
описан в работе [105]. Суть предлагаемого подхода заключается в вытеснении
цитрат-ионов молекулами тиолсодержащих аминокислот за счет более сильного
взаимодействия атома серы меркаптогруппы с атомом золота на поверхности
наночастиц, что приводит к уменьшению заряда последних и их агрегации. Путем
замещения меркаптогруппы в молекуле гомоцистеина на гидроксил доказано, что за
образование прочной связи с поверхностью НЧ золота отвечает именно
меркаптогруппа (в случае введения в раствор наночастиц гидроксилзамещенного
производного изменения оптических свойств системы не наблюдалось).
Принципиальным отличием данного примера от описанного выше является факт
замещения цитрат-ионов на поверхности золота. По сути, в этом случае между
определяемым соединением и наночастицами золота реализуются специфические
взаимодействия, приводящие к образованию ковалентной связи с поверхностью
наночастицы, что, с одной стороны, делает такой подход более селективным по
отношению к соединениям, не содержащим серу, а с другой – накладывает некоторые
ограничения на круг определяемых таким образом соединений.
Есть
сведения, что механизм, основанный на непосредственном взаимодействии
функциональных групп определяемого соединения с золотом, реализуется не только
в случае тиолсодержащих соединений. Полагают [106], что за счет специфических
взаимодействий аминогрупп меламина с поверхностными атомами золота также
происходит вытеснение цитрат-ионов с поверхности наночастиц, что приводит к
уменьшению их агрегативной устойчивости. Предлагаемый метод позволяет определять
меламин в молоке и детском питании с пределом обнаружения 1,0 мкг/мл в варианте
визуальной колориметрии и 0,15 мкг/мл в варианте спектрофотометрии [106].
Помимо
описанных выше примеров, наночастицы золота, стабилизированные цитратом, использовали
для определения цистеамина [107], цистеина [108], кокаина [109], дофамина [110],
аденозинтрифосфата [111], глюкозы [112, 113] и аскорбиновой кислоты [114]. К
достоинствам описанных методик можно отнести относительную простоту получения
наночастиц, а к недостаткам – сильное мешающее влияние со стороны положительно
заряженных соединений или ионов. Для устранения мешающего влияния со стороны
катионов щелочноземельных и тяжелых металлов при определении цистеамина
предложено использовать динатриевую соль ЭДТА [107]. ЭДТА маскирует катионы,
переводя их в отрицательно заряженные комплексонаты, которые уже не способны
нейтрализовать заряд НЧ и вызывать их агрегацию.
В
ряде случаев для определения органических соединений более эффективно
использование наночастиц золота, модифицированных другими соединениями. В
качестве модификаторов используют (в скобках указано определяемое соединение)
поверхностно-активные вещества (цистеин) [115], тиоамины (тринитротолуол,
меламин) [116, 117], краун-эфиры (меламин) [118], тиокислоты (стрептомицин) [119],
тиолсодержащие аминокислоты (тринитротолуол) [120] и их производные (тирозин) [121],
антигены (кортизол) [122], ДНК (теофиллин, меламин) [123, 124], люминофоры
(меламин, пестициды) [125, 126], полимеры (цистеин) [127]. Принципы
взаимодействия аналитов с модифицированными НЧ остаются теми же, что и для
ионов металлов и анионов. Так, способ определения тринитротолуола основан на
донорно-акцепторном взаимодействии этого соединения с цистеином – модификатором
НЧ [120]. Метод позволяет определять тринитротолуол на пикомолярном уровне.
Другие примеры
спектрофотометрического и визуально-колориметрического определения
низкомолекулярных органических соединений приведены в табл. 3.
***
Таким
образом, можно отметить, что в последние пять лет число публикаций по
использованию наночастиц золота в спектрофотометрии заметно возросло. Применение
наночастиц золота в спектрофотометрии основано на эффекте поверхностного
плазмонного резонанса, который проявляется в возникновении интенсивной полосы
поглощения в видимой области спектра. Этот эффект используют для разработки
методик определения ионов металлов, анионов и органических соединений. Основными
фактами, свидетельствующими в пользу применения наночастиц золота в
спектрофотометрии, являются относительная простота получения, высокие молярные
коэффициенты поглощения, а также практически неограниченная возможность
регулирования спектральных и химических характеристик наночастиц изменением их
размеров, формы и химического окружения. Методики спектрофотометрического
определения, основанные на применении наночастиц золота, отличаются простотой и
экспрессностью. Благодаря контрастному изменению цвета растворов их легко можно
реализовать и в тест-варианте.
В практике
применения НЧ золота в спектрофотометрии для анализа реальных объектов есть ряд
нерешенных вопросов. В реальных объектах, таких, например, как биологические
жидкости (кровь, моча), пищевые продукты или объекты окружающей среды,
присутствуют различные соли или другие вещества, способные вызывать агрегацию
наночастиц и в отсутствие определяемых компонентов. Между тем, сведения об
использовании маскирующих агентов для устранения такого влияния единичны. Кроме
того, чувствительность разработанных методик спектрофотометрического
определения не всегда соответствует реальному (более низкому) содержанию определяемых
компонентов.
Таблица
1.
Примеры спектрофотометрического (СФ) и визуально-колориметрического (ВК)
определения ионов металлов в различных объектах с помощью наночастиц золота
|
Ион
|
Объект
анализа
|
Метод
синтеза НЧ (модификатор)
|
сmin
|
Метод
|
Литература
|
|
Hg(II)
|
Грунтовые воды
|
Цитратный
(олигонуклеотид)
|
10 нМ
|
СФ
|
[52]
|
|
Природные воды
|
Цитратный
(ДНК)
|
10 нМ
|
СФ
|
[37], [53]
|
|
Водные растворы
|
Боргидридный, (дитиадиазо-2-[3-(2-амино-этилсульфанил)пропил-сульфанил]этиламин)
|
35
нM
|
СФ
|
[37]
|
|
Pb(II)
|
Водные
растворы
|
Цитратный
(пептид)
|
242 нМ
|
ВК
|
[29]
|
|
Морская вода,
моча, кровь
|
Цитратный (бычий сывороточный
альбумин)
|
50 пM
|
ВК
|
[64]
|
|
Cd(II)
|
Озерная вода
|
Цитратный (6-меркапто-никотиновая
кислота и L-цистеин)
|
100 нM
|
СФ
|
[91]
|
|
Co(II)
|
Водные
растворы
|
Цитратный
(пептид)
|
190 нМ
|
ВК
|
[29]
|
|
Cu(II)
|
Водные
растворы
|
Цитратный
(ДНК)
|
5
мкМ
|
ВК
|
[80]
|
|
Pd(IV),
|
Водные
растворы
|
Цитратный
(пептид)
|
31
нМ
|
ВК
|
[29]
|
|
Pt(IV)
|
23 нМ
|
|
K(I)
|
Водные
растворы
|
Цитратный
|
1 мМ
|
СФ, ВК
|
[89]
|
|
Ca(II)
|
Плазма крови
|
Цитратный
(кальсеквестрин)
|
1 мМ
|
СФ, ВК
|
[82]
|
|
As(III)
|
Грунтовые воды
|
Цитратный
(глутатион, дитиотреитол и цистеин)
|
0,13 нМ
|
СФ, ВК
|
[85], [86]
|
|
Cr(III)
|
Водные
растворы
|
Цитратный
(5,5’-дитио- бис (2-нитробензойная кислота)
|
1,8 мкМ
|
СФ, ВК
|
[70]
|
|
Речная вода
|
Боргидридный (триполифосфат P3O105-)
|
100 нM
|
ВК
|
[72]
|
|
Al(III)
|
Поверхность
цервикальных раковых клеток
|
Цитратный
(пентапептид)
|
0,2 мкМ
|
СФ, ВК
|
[88]
|
|
Ag(I)
|
Водные
растворы
|
Цитратный
(ДНК)
|
0,59 нМ
|
СФ, ВК
|
[81]
|
Таблица
2.
Примеры спектрофотометрического (СФ) и визуально-колориметрического (ВК)
определения анионов в различных объектах с помощью наночастиц золота
|
Анион
|
Объект
анализа
|
Метод
синтеза НЧ (модификатор)
|
сmin
|
Метод
|
Лите-ратура
|
|
H2PO4-
|
Модельная
система на основе дихлорметана
|
Боргидридный (фенилмочевина)
|
10 мкМ
|
СФ
|
[94]
|
|
PO43-
|
Речная вода
|
Цитратный (меркаптоуксусная кислота и Eu3+)
|
76 нМ
|
СФ
|
[95]
|
|
Оксо-анионы (HPO42-)
|
Водные
растворы
|
Боргидридный (изотиуроний)
|
100 мкМ
|
СФ, ВК
|
[96]
|
|
F-
|
Водные
растворы
|
Восстановление тиоглюкозой (тиоглюкоза)
|
20 мМ
|
ВК
|
[97]
|
|
NO2-
|
Природные воды
|
Цитратный (производные анилина и
нафтиламина)
|
22 мкМ
|
ВК
|
[100]
|
|
CN-
|
Водные растворы
|
Цитратный (аденозинтрифосфат)
|
14 мкМ
|
СФ, ВК
|
[99]
|
|
SO42-
|
Водные
растворы
|
Боргидридный (цистеамин)
|
50 мкг/л
|
ВК
|
[101]
|
|
S2-
|
Сточные воды
|
Цитратный (каликс[4]арен)
|
10 нМ
|
СФ, ВК
|
[102]
|
|
ClO-
|
Водопроводная
вода
|
Цитратный (меркаптоундекановая
кислота)
|
1,5 мкМ
|
ВК
|
[103]
|
|
Cr2O72-
|
Природные воды
|
Цитратный (дитиотреитол)
|
20 нМ
|
СФ
|
[75]
|
Таблица 3. Примеры
спектрофотометрического (СФ) и визуально-колориметрического (ВК)
определения низкомолекулярных органических соединений в различных объектах с
помощью наночастиц золота
|
Соединение
|
Объект анализа
|
Метод синтеза НЧ (модификатор)
|
сmin
|
Метод
|
Лите-ратура
|
|
Катионные ПАВ
|
Кондиционер
для волос
|
Цитратный
|
–
|
ВК
|
[104]
|
|
Цистеин
|
Водные
растворы
|
Тот
же
|
1 мкМ
|
СФ
|
[108]
|
|
Моча
|
Цитратный
(фторсодержащее ПАВ)
|
0,8 мкМ
|
СФ,
ВК
|
[115]
|
|
Водные
растворы
|
Цитратный
|
10 нM
|
ВК
|
[128]
|
|
Меламин
|
Молоко,
детское
питание
|
Тот
же
|
0,15 мкг/мл
|
СФ;
ВК
|
[106]
|
|
Молоко
|
Цитратный
(политимин)
|
0,02 мкМ
|
СФ,
ВК
|
[124]
|
|
Водные
растворы
|
Боргидридный
(рибофлавин)
|
0,25-0,5 мкМ
|
СФ
|
[125]
|
|
Молоко
|
Цитратный
(цистеамин)
|
1 мг/л
|
СФ
|
[117]
|
|
Тиолсодержащие
аминокислоты
|
Водные
растворы
|
Цитратный
|
3 мкМ
|
ВК
|
[105]
|
|
Цистеамин
|
Моча, средство
для завивки волос
|
Тот
же
|
0,01 мкг/мл
|
СФ
|
[107]
|
|
Кокаин
|
Водные
растворы
|
»
|
2
мкМ
|
ВК
|
[109]
|
|
Дофамин
|
Водные
растворы
|
»
|
0,03
мкМ
|
СФ, ВК
|
[110]
|
|
Аденозин-трифосфат
|
Водные
растворы
|
»
|
0,6
мкМ
|
СФ, ВК
|
[111]
|
|
Глюкоза
|
Микродиализат
мозга мыши
|
»
|
1
мМ
|
СФ, ВК
|
[112]
|
|
Сыворотка
крови
|
»
|
10
нM
|
СФ
|
[113]
|
|
Аскорбиновая
кислота
|
Фруктовый сок
|
»
|
3
нM
|
ВК
|
[114]
|
|
Тринитротолуол
|
Природные воды
|
Цитратный
(цистеамин)
|
0,5
пМ
|
СФ,
ВК
|
[116]
|
|
Стрептомицин
|
Молоко
|
Цитратный
(меркаптоуксус-ная кислота)
|
50
мкг/л
|
СФ
|
[119]
|
|
Кортизол
|
Сыворотка
крови
|
Цитратный
(антиген*)
|
30
нг/мл
|
ВК
|
[122]
|
|
Теофиллин
|
Водные
растворы
|
Цитратный
(ДНК)
|
200 мкМ
|
СФ
|
[123]
|
|
Фосфор-органические
пестициды и карбаминаты
|
Речная
вода
|
Цитратный
(родамин С)
|
0,
1– 1 мкг/л
|
СФ
|
[126]
|
|
Тиолы
|
Водные
растворы
|
Цитратный
(дисульфид)
|
1 мкМ
|
ВК
|
[129]
|
*Кортизол-3-карбоксиметилоксим-адипиновой
кислоты дигидразид-бычий сывороточный альбумин.
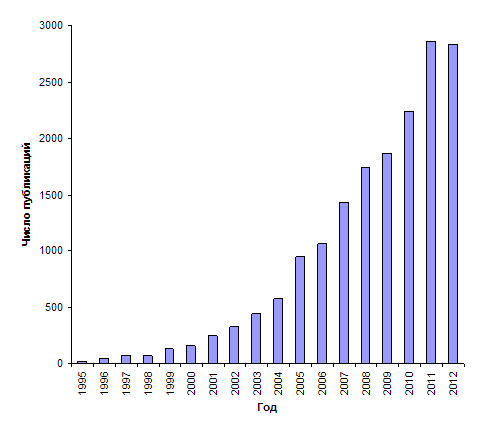
Рис. 1. Число публикаций в базе данных Scopus, в названиях которых встречается приставка «нано» и слово «золото».
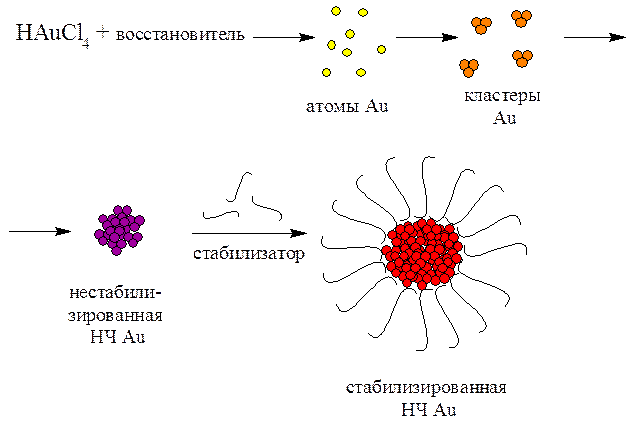 Рис.
2. Схема синтеза наночастиц золота.
Рис.
2. Схема синтеза наночастиц золота.
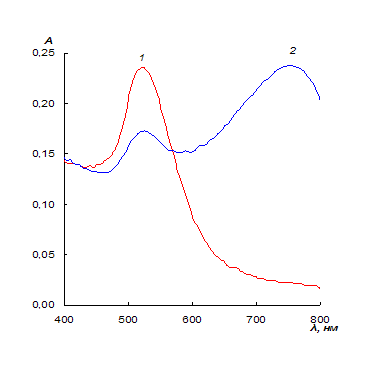 Рис. 3. Типичные спектры поглощения наночастиц золота (1) и их агрегатов (2).
Рис. 3. Типичные спектры поглощения наночастиц золота (1) и их агрегатов (2).
а б
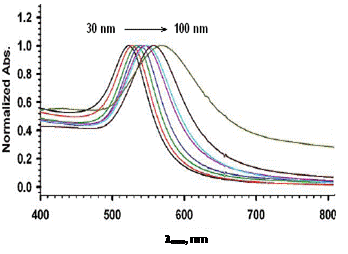
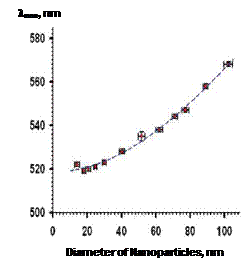
Рис. 4. Нормированные спектры поглощения НЧ золота различных размеров (а) и зависимость длины волны максимума поглощения от диаметра наночастиц (б)
а
б
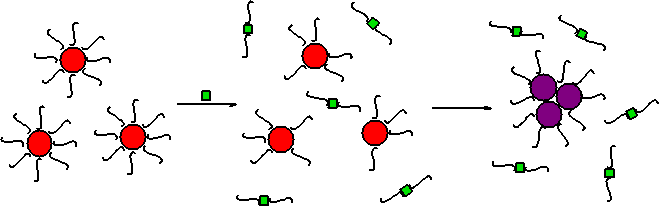
Рис.5. Схема агрегации наночастиц золота со сшиванием (а) и без сшивания (б).
Авторы выражают благодарность РФФИ за финансовую поддержку (грант № 13-03-00100)
СПИСОК ЛИТЕРАТУРЫ
1.
Дыкман Л.А., Богатырев В.А., Щеголев С.Ю., Хлебцов
Н.Г.
Золотые наночастицы. Синтез, свойства, биомедицинское применение. М.: Наука, 2008.
319 с.
2.
Дыкман Л.А., Богатырев В.А.
// Успехи химии. 2007. Т. 76. С. 199.
3.
Algar
W.R.,
Massey
M., Krull
U.J.
// Trend. Anal.
Chem. 2009. V.
28. P. 292.
4.
Dreaden
E.C.,
Alkilany
A.M.,
Huang
X., Murphy
C.J.,
El-Sayed
M.A.
// Chem. Soc.
Rev. 2012. V.
41. P. 2740.
5.
Nguyen
D.T.,
Kim
D.-J.,
Kim
K.-S.
// Micron. 2011.
V. 42. P. 207.
6.
Jans H. Huo Q.
// Chem. Soc. Rev. 2012. V. 41. P. 2849.
7.
Agasti S.S., Rana S., Park M.-H., Kim
C.K., You C.-C., Rotello V.M. // Adv. Drug Deliver. Rev. 2010. V. 62. P. 316.
8.
Wang Z., Mа
L. // Coordin. Chem. Rev. 2009. V. 253. P.
1607.
9.
Yong K.-T., Swihart M.T., Ding H.,
Prasad P.N. // Plasmonics. 2009.
V. 4. P. 79.
10. Pissuwan D., Cortie C.H., Valenzuela S.M., Cortie M.B.
// Trend.
Biotechnol. 2010. V.28. P. 207.
11. Guo
S.J., Wang E.K. // Anal. Chim.
Acta. 2007. V. 598. P. 181.
12. Вертелов
Г.К., Оленин А.Ю., Лисичкин Г.В. // Журн. аналит.
химии. 2007. Т. 62. C. 903.
13. Nilsson
C., Birnbaum
S., Nilsson
S. //
J. Chromatogr.
A. 2007. V.
1168. P. 212.
14. Sýkora
D., Kašičkа
V., Mikšik
I., Řezanka
P., Zăruba
K., Matějka
P., Král
V. // J.
Sep. Sci.
2010.
V. 33. P.
372.
15. Штыков
С.Н., Русанова Т.Ю. // Рос. хим. ж. (Ж. Рос. хим. об-ва им.
Д.И. Менделеева). 2008. Т. 52. С. 92.
16. Saha K., Agasti S.S., Kim
C., Li X., Rotello V.M. // Chem. Rev. 2012. V.
112. P. 2739.
17. Guo
S., Dong S. // Trend. Anal. Chem. 2009. V. 28.
P. 96.
18. Mayer
K.M., Hafner J.H. //
Chem. Rev. 2011.
V. 111. P.
3828.
19. Upadhyayula V.K.K. //Anal.
Chim. Acta . 2012. V. 715.
P. 1.
20. Zhang
B., Yan B. // Anal. Bioanal. Chem. 2010. V. 396.
P. 973.
21. Ghosh
S.K., Pal T. // Chem. Rev. 2007. V. 107. P.
4797.
22. Saarinen
J.J., Vartiainen E.M., Peiponen K.-E.
// Sensor. Actuat. B. 2009. V. 138. P. 383.
23. Kumar
S., Gandhi K.S., Kumar R. // Ind. Eng. Chem. Res. 2007. V. 46. P. 3128.
24. Ji
X., Song X., Li J., Bai Y., Yang W., Peng X.
// J. Am. Chem. Soc. 2007. V. 129. P. 13939.
25. Nguyen
D.T., Kim D.-J, Kim K.-S. // Adv. Powder.
Technol. 2010. V. 21. P. 111.
26. Zhao
W., Brook M.A., Li Y.. // ChemBioChem. 2008.
V. 9. P. 2363.
27. Njoki
P.N., Lim I.S., Mott D., Park H.-Y., Khan B., Mishra S., Sujakumar R., Luo J.,
Zhong C.-J. // J. Phys. Chem. C. 2007. V. 111.
P. 14664.
28. Khlebtsov
N.G. // Anal. Chem. 2008. V.
80. P.6620.
29. Slocik
J.M., Zabinski J.S Jr., Phillips D.M., Naik R.R.
// Small. 2008. V. 4. P. 548.
30. Fan
A., Ling Y., Lau C., Lu J. // Talanta. 2010. V.
82. P. 687.
31. Lou
T., Chen Z., Wang Y., Chen L. // ACS Appl. Mater. Interfaces.
2011. V. 3. P. 1568.
32. Ding
N., Zhao H., Peng W., He Y., Zhou Y., Yuan L., Zhang Y.
// Colloid. Surface. A: Physicochem. Eng. Aspects. 2012. V. 395. P. 161.
33. Liu
Z., Hu J., Tong S., Cao Q., Yuan H.
// Spectrochim. Acta. A: Molecular and Biomolecular Spectroscopy. 2012. V. 97.
P. 737.
34. Darbha
G.K., Singh A.K., Rai U.S., Yu E., Yu H., Ray P.C.
// J. Am. Chem. Soc. 2008. V. 130. P. 8038.
35. Bi
N., Chen Y., Qi H., Zheng X., Chen Y., Liao X., Zhang H., Tian Y.
// Spectrochim. Acta. A: Molecular and Biomolecular Spectroscopy. 2012. V. 95.
P. 276.
36. Bi
N., Chen Y., Qi H., Zheng X., Chen Y., Liao X., Zhang H., Tian Y..
// Sensor. Actuat. B. 2012. V. 166 –167. P. 766.
37. Chansuvarn
W., Imyim A.. // Microchim. Acta. 2012. V. 176.
P. 57.
38. Chung
C.H., Kim J.H., Jung J., Chung B.H. // Biosens. Bioelectron.
2013. V. 41. P. 827.
39. Yu
C.J., Cheng T.L., Tseng W.L. // Biosens.
Bioelectron. 2009. V. 25. P. 204.
40. Duan
J., Guo Z.Y. // Chinese Chem. Lett. 2012. V.
23. P. 225.
41. Guo
Z., Duan J., Yang F., Li M., Hao T., Wang S., Wei D.
// Talanta. 2012. V. 93. P. 49.
42. Tan
Z.-Q., Liu J.-F., Liu R., Yin Y.-G., Jiang G.-B.
// Chem. Commun. 2009. P. 7030.
43. Wu
J., Li L., Zhu D., He P., Fang Y., Cheng G.
// Anal. Chim. Acta. 2011. V. 694. P. 115.
44. Leng
B., Zou L., Jiang J., Tian H. // Sens. Actuat. B.
2009. V. 140. P. 162.
45. Huy
G.D., Zhang M., Zuo P., Ye B.-C. // Analyst. 2011.
V. 136. P. 3289.
46. Wang
Y., Yang F., Yang X. // Biosens. Bioelectron.
2010. V. 25. P. 1994.
47. Hung
Y.-L., Hsiung T.-M., Chen Y.-Y., Huang Y.-F., Huang C.-C.
// J. Phys. Chem. C. 2010. V. 114. P. 16329.
48. Liu
D., Qu W., Chen W., Zhang W., Wang Z., Jiang X.
// Anal. Chem. 2010. V. 82. P. 9606.
49. Chen
X., Zu Y., Xie H., Kemasa A.M., Gao Z.
// Analyst. 2011. V. 136. P. 1690.
50. Radhakumary
C., Sreenivasan K. // Analyst. 2011. V.
136. P. 2959.
51. Kim
Y.-R., Mahajan R. K., Kim J.S., Kim H.
// Applied Materials. 2010. V. 2. P. 292.
52. Li
D., Wieckowska A., Willner I. // Angew. Chem.
Int. Ed. 2008. V. 47. P. 3927.
53. Lee
J.-S., Mirkin C.A. // Anal. Chem. 2008.
V. 80. P. 6805.
54. Lin
Y.W., Huang C.C., Chang H.T. // Analyst. 2011. V.
136. P. 863.
55. Lin
C.-Y., Yu C.-J., Lin Y.-H., Tseng W.-L.
// Anal. Chem. 2010. V. 82. P. 6830.
56. Lee J.-S., Han M.S., Mirkin C.A. // Angew. Chem. 2007. V. 46. P.
4093.
57. He S., Li D., Zhu C., Song S., Wang L.,
Long Y., Fan C.
// Chem. Commun. 2008. P. 4885.
58. Xue X. J., Wang F., Liu X. G. // J. Am. Chem.
Soc. 2008. V. 130. P. 3244.
59. Li L., Li B., Qi Y., Jin Y. // Anal. Bioanal.
Chem. 2009. V. 393. P. 2051.
60. Xu X., Wang J., Jiao K., Yang X. // Biosens. Bioelectron.
2009. V. 24. P. 3153.
61. Liu C.-W., Hsieh Y.-Y., Huang C.-C., Lin
Z.-H., Chang H.-T.
// Chem. Commun. 2008. P. 2242.
62. Wang L.H., Zhang J., Wang X., Huang Q., Pan D., Song
S.P., Fan C.H. // Gold. Bull. V. 41. P. 37.
63.
Liu D., Wang Z., Jiang X.
// Nanoscale. 2011. V. 3. P. 1421.
64.
Lee Y.F. Huang C.C.
// ACS Appl. Mater. Interfaces. 2011. V. 3. P. 2747.
65.
Hung Y.-L., Hsiung T.-M., Chen Y.-Y.,
Huang C.-C. // Talanta. 2010. V. 82. P. 516.
66. Chai
F., Wang C., Wang T., Li L., Su Z. // Applied
Materials. 2010. V. 2. 1466.
67. Beqa
L., Singh A.K., Khan S. A., Senapati D., Arumugam S.R., Ray P.C.
// ACS Appl. Mater. Interfaces. 2011. V. 3. P. 668.
68. Zhu
D., Lib X., Liu X., Wang J., Wang Z. // Biosens. Bioelectron.
2012. V. 31. P. 505.
69. Miao
X.-M., Ling L.-S., Shuai X.-T. // Anal. Biochem. 2012. V. 421. P. 582.
70. Dang Y.Q., Li H.W., Wang B., Li L., Wu
Y.Q. // ACS Appl. Mater.
Interfaces. 2009. V. 1. P. 1533.
71. Zhao
L., Jin Y., Yan Z., Liu Y., Zhu H. // Anal. Chim.
Acta. 2012. V. 731. P. 75.
72. Xin J., Miaо L., Chen S., Wu A. // Anal. Meth.
2012. V. 4. P. 1259.
73. Xin J., Zhang F., Gao Y., Feng Y., Chen S., Wu A. // Talanta. 2012.
V. 101. P. 122.
74. Lai
Y.-J., Tseng W.-L. // Analyst. 2011.
V. 136. P. 2712.
75. Tan F., Liu X., Quan X., Chen J., Li X., Zhao H. // Anal. Methods.
2011. V. 3. P. 343.
76. Hua C., Zhang W.H., Almeida S.R. M.,
Ciampi S., Gloria D., Liu G., Harper J.B., Gooding J.J. // Analyst. 2012. V. 137. P. 82.
77. Shen
Q., Li W., Tang S., Hu Y., Nie Z., Huang Y., Yao S.
// Biosens. Bioelectron. 2012. V. 41. P. 663.
78. Liu
J.-M., Wang H.-F., Yan X.-P. // Analyst. 2011.
V. 136. P. 3904.
79. Lou T., Chen L., Chen Z., Wang Y., Chen
L., Jinhua L.
// ACS Appl. Mater. Interfaces. 2011. V. 3. P. 4215.
80. Liu J.W., Lu Y. // Chem. Commun. 2007. V. 43. P. 4872.
81. Li B.L., Du Y., Dong S.J. // Anal. Chim. Acta. 2009. V. 644. P. 78.
82. Kim S., Park J.W., Kim D., Kim D., Lee I.H., Jon S. // Angew. Chem.,
Int. Ed. 2009. V. 48. P. 4138.
83. Zhang
J., Wang Y., Xu X., Yang X. //
Analyst. 2011. V. 136. P. 3865.
84. Velu R., Ramakrishnan V.T., Ramamurthy
P. // Tetrahedron Lett.
2010. V. 51. P. 4331.
85. Kalluri J.R., Arbneshi T., Khan S.A.,
Neely A., Candice P., Varisli B., Washington M., McAfee S., Robinson B.,
Banerjee S., Singh A.K., Senapati D., Ray P.C.
// Angew. Chem. Int. Ed. 2009. V. 48. P. 9668.
86. Wu Y., Zhan S., Wang F., He L., Zhi W.,
Zhou P. // Chem.
Commun. 2012. V. 48. P. 4459.
87. Hong S., Park S., Lee S., Yang Y.-I.,
Song H. D., Yi J.
// Anal. Chim. Acta. 2011. V. 694. P. 136.
88. Li X.K., Wang J., Sun L.L., Wang Z.X. // Chem. Commun.
2010. V. 46. P. 988.
89. Wang L., Liu X., Hu X., Song S., Fan C. // Chem. Commun. 2006. V. 42. P. 3780.
90. Wu S.-P., Chen Y.-P., Sung Y.-M. // Analyst. 2011.
V. 136. P. 1887.
91. Ying X., Zhao H., Wu Z., Li X., He Y.,
Yuan Z. // Analyst.
2011. V. 136. P. 3725.
92. Lisowski C.E., Hutchison J.E. //
Anal. Chem. 2009.
V. 81. P. 10246.
93. Lee J.H., Wang Z., Liu J., Lu Y. // J. Am. Chem.
Soc. 2008. V. 130. P. 14217.
94. Kado S., Furui A., Akiyama Y., Nakahara Y., Kimura K. // Anal. Sci. 2009. V.
25. P. 261.
95.
Liu W., Du Z., Qian Y., Li F. // Sensor. Actuat. B:
Chemical. 2013. V. 176. P. 927.
96. Kubo
Y., Uchida S., Kemmochi Y., Okubo T. // Tetrahedron Lett.
2005. V. 46. P. 4369.
97. Watanabe S.,
Seguchi H., Yoshida K., Kifune K., Tadaki T., Shiozaki H. // Tetrahedron
Lett. 2005. V. 46. P. 8827.
98. Minami T., Kaneko K., Nagasaki T., Kubo Y.
// Tetrahedron Lett. 2008. V. 49. P. 432.
99. Kim M.H., Kim S., Jang H.H., Yi S., Seo S.H., Han M.S.
// Tetrahedron Lett. 2010. V. 51. P. 4712.
100. Daniel W.L.,
Han H.S., Lee J.S., Mirkin C.A. // J. Am.
Chem. Soc. 2009. V. 131. P. 6362.
101. Zhang Min, Liu
Y.-Q., Ye B.-C. // Analyst. 2011. V.
136. P. 4558.
102. Pandya A.,
Joshi K.V., Modi N.R., Menon S.K. // Sensor.
Actuat. B. 2012. V. 168. P. 54.
103. Zhang J., Wang
X., Yang X. // Analyst. 2012.
V. 137. P. 2806.
104. Kuong C.-L., Chen W.-Y.,
Chen Y.-C. // Anal. Bioanal. Chem. 2007. V. 387. P.
2091.
105. Zhang F.X., Han L., Israel L.B., Daras J.G., Maye M.M., Ly N.K., Zhong C.-J. // Analyst. 2002. V. 127. P. 462.
106. Guo L., Zhong J., Wu J., Fu
F., Chen G., Zheng X., Lin S. // Talanta. 2010. V. 82. P. 1654.
107. Apyari V.V., Dmitrienko
S.G., Arkhipova V.V., Atnagulov A.G., Zolotov Yu.A. // Anal. Methods. 2012. V. 4. P. 3193.
108. Rezanka P., Rezankova H., Matejka P., Kral V. // Colloid. Surface. A: Physicochem. Eng. Aspects. 2010. V. 364.
P. 94.
109. Zhang
J., Wang L.H., Pan D., Song S.P., Boey F.Y.C., Zhang H., Fan C.H. //
Small. 2008. V. 4. P. 1196.
110. Zhang Y.F., Li B.X., Chen X.L. // Microchim. Acta. 2010. V. 168. P. 107.
111. Wang
J., Wang L.H., Liu X.F., Liang Z.Q., Song S.P., Li W.X., Li G.X., Fan C.H..
// Adv. Mater. 2007. V. 19. P. 3943.
112. Jiang
Y., Zhao H., Lin Y.Q., Zhu N.N., Ma Y.R., Mao L.Q.
// Angew. Chem., Int. Ed. 2010. V. 49. P. 4800.
113. Li
T., Zhu K., He S., Xia X., Liu S., Wang Z., Jiang X.
// Analyst. 2011. V. 136. P. 2893
114. Zhang Y., Li B., Xu C. // Analyst. 2010. V. 135. P. 1579.
115. Lu C., Zu Y.B. // Chem. Commun. 2007. V.43. P.
3871.
116. Jiang Y., Zhao H., Zhu N.N.,
Lin Y.Q., Yu P., Mao L.Q. // Angew. Chem., Int. Ed. 2008. V. 47. P. 8601.
117. Liang X., Wei H., Cui Z.,
Deng J., Zhang Z., You X., Zhang X.E. // Analyst. 2011. V. 136. P. 179.
118. Ai K., Liu Y., Lu L. // J. Am. Chem. Soc. 2009. V. 131. P. 9496.
119. Sun J., Ge J., Liu W., Fan
Z., Zhang H., Wang P. // Chem. Commun. 2011. V. 47. P. 9888.
120. Dasary S.S.R., Singh A.K., Senapati D., Yu H., Ray P.C. // J. Am. Chem. Soc. 2009. V. 131. P. 13806.
121. Su H., Zheng Q., Li H. // J. Mater. Chem. 2012. V. 22. P.
6546.
122. Nara S., Tripathi V., Singh
H., Shrivastav T.G. // Anal. Chim. Acta. 2010. V. 682. P. 66.
123. Chavez J.L., Lyon W.,
Kelley-Loughanane N., Stone M.O. // Biosens. Bioelectron. 2010. V. 26. P. 23.
124. Qi W.J., Wu D., Ling J.,
Huang C.Z. //
Chem. Commun. 2010. V. 46. P. 4893.
125. Roy B., Saha A., Nandi A.K. // Analyst. 2011. V. 136. P. 67.
126. Liu D., Chen W., Wei J., Li
X., Wang Z., Jiang X. // Anal. Chem. 2012. V. 84. P. 4185.
127. Wei X., Qi L., Tan J., Liu
R., Wang F. //
Anal. Chim. Acta. 2010. V. 671. P. 80.
128. Li
L., Li B. // Analyst. 2009. V. 134. P. 1361.
129. Durocher
S., Rezaee A., Hamm C., Rangan C., Mittler S., Mutus B..
// J. Am. Chem. Soc. 2009. V. 131. P. 2475.
Статья сотрудников МГУ

 Рис.
2. Схема синтеза наночастиц золота.
Рис.
2. Схема синтеза наночастиц золота. Рис. 3. Типичные спектры поглощения наночастиц золота (1) и их агрегатов (2).
Рис. 3. Типичные спектры поглощения наночастиц золота (1) и их агрегатов (2).


